题目内容
标准状况下,某气态有机物密度为3.125g/L,则该有机物的最简式可能是( )
| A、CH |
| B、CH2 |
| C、CH3 |
| D、CH2O |
考点:有机物实验式和分子式的确定
专题:有机物分子组成通式的应用规律
分析:根据标况下气体密度计算该气体的摩尔质量,在数值上等于该气体的相对分子质量,根据最简式计算最简式的式量,根据相对分子质量=最简式的式量的整数倍判断选项.
解答:
解:摩尔质量=Vm×ρ=22.4L/mol×3.125g/L=70g/mol,因此该气体的相对分子质量为70,CH的式量为13,CH2的式量为14,CH3的式量为15,CH2O的式量为29,
,只有70是14的整数倍,故选B.
,只有70是14的整数倍,故选B.
点评:本题考查了物质的量的相关计算,明确物质的相对分子质量和最简式式量的关系是解题的关键.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
下列反应既属于离子反应,又是氧化还原反应的是( )
| A、NaOH溶液与盐酸中和 |
| B、分解氯酸钾制氧气 |
| C、Zn与CuSO4 溶液的反应 |
| D、钠与水反应 |
已知反应:
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
2FeCl3+2KI═2FeCl2+2KCl+I2;
2FeCl2+Cl2═2FeCl3;
I2+SO2+2H2O═H2SO4+2HI;
下列物质的氧化性由强到弱的顺序是( )
| A、FeCl3>I2>Cl2>H2SO4 |
| B、FeCl2>FeCl3>Cl2>I2 |
| C、Cl2>FeCl3>I2>H2SO4 |
| D、Cl2>H2SO4>I2>FeCl3 |
金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是( )
| A、氧化剂是O2 |
| B、HO2在碱中不能稳定存在 |
| C、氧化产物是HO2 |
| D、1mol Cu参加反应有1mol电子发生转移 |
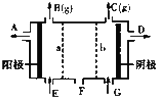 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |