题目内容
19.铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: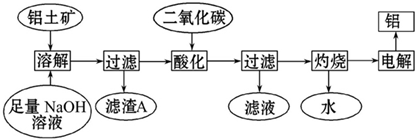
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O.
(2)滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;滤渣A的用途是作炼铁的原料(或作生产硅酸盐产品的原料)(只写一种);实验室过滤时使用玻璃棒,其作用是引流.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是:将NaAlO2完全转化为Al(OH)3.
(4)若将铝溶解,下列试剂中最好选用B(填编号).
A.浓硫酸 B.稀硫酸 C.稀硝酸.
分析 铝土矿的主要成分是Al2O3,另外含有的少量SiO2均能溶解于过量NaOH溶液,过滤除去其中不溶于NaOH的Fe2O3等杂质及生成的Na2Al2Si2O8,所得滤液为NaAlO2及过量NaOH的溶液,通入过量CO2可得到Al(OH)3沉淀,过滤、洗涤再加热分解可得到Al2O3,最后电解氧化铝可得到铝,
(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,氧化铁用于冶炼铁,过滤利用玻璃棒引流;
(3)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀;
(4)根据Al的化学性质及不生成有毒气体来解答.
解答 解:(1)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,离子反应分别为Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(2)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8,氧化铁用于冶炼铁,过滤利用玻璃棒引流,
故答案为:Fe2O3、Na2Al2Si2O8;作炼铁的原料(或作生产硅酸盐产品的原料);引流;
(3)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,所以第三步中,选用二氧化碳作酸化剂的原因为将NaAlO2完全转化为Al(OH)3,故答案为:将NaAlO2完全转化为Al(OH)3;
(4)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B.
点评 本题考查Al的化学性质,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | O、S、Na | B. | Mg、P、Cl | C. | Cl、Na、F | D. | S、N、C |
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

(1)图1中装置A的仪器①、②名称分别为温度计、圆底烧瓶_;
(2)实验过程中向B装置(溴水)中通入制备所得到的气体,溶液的颜色很快褪去,分析使B中溶液褪色的物质:
a.甲认为是C2H4.根据甲的判断,写出反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br;该反应属于加成反应(填反应类型);
b.乙根据现象Ⅲ认为,在制取乙烯的实验中因温度过高使乙醇和浓硫酸反应生成少量的SO2,不能排除SO2的影响.根据乙的观点,写出在B中与SO2 反应使溶液褪色的反应方程式SO2+Br2+2H2O=2H2SO4+2HBr;
II.有人设计如图2装置进行实验以确认上述混合气体中有乙烯及二氧化硫.试回答下列问题:
(3)图中①②③④装置内,添加选择合适的试剂进行实验,以确认混合气体内的成分(按照仪器顺序从左到右填序号,可重复选择试剂):①A;②B;③A;④D;
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(4)根据装置内所选择的试剂,能说明二氧化硫气体存在的现象是装置①品红溶液褪色;使用装置②的目的是除去混合气体中的SO2,避免干扰实验结果;
(5)确定含有乙烯的现象是装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.

下列反应中全部符合上述图象的反应是( )
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g) (正反应为吸热反应) | |
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g) (正反应为放热反应) | |
| D. | 2HI(g)?I2(g)+H2(g) (正反应为吸热反应) |