题目内容
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A、原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B、W的氯化物水瑢液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C、若由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D、已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,只能为H、Be、Al中的两种,Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体,应为NH3,则X为H元素,Y为N元素,Z为F,结合原子序数可知W为Al,据此解答.
解答:
解:原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,只能为H、Be、Al中的两种,Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体,应为NH3,则X为H元素,Y为N元素,Z为F,结合原子序数可知W为Al,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>N>F,电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->F->Al3+,故A错误;
B.氯化铝溶液中滴入过量的NaF溶液可以生成络合物--Na3AlF6,故B正确;
C.若由H、N、F组成盐为NH4F,其水溶液呈酸性,说明铵根离子水解程度大于氟离子水解程度,则溶液中该盐阳离子浓度小于酸根离子浓度,故C错误;
D.键能影响物质的稳定性,不能影响沸点,NH3沸点远高于NF3,应是NH3分子值存在氢键所致,故D错误,
故选B.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>N>F,电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->F->Al3+,故A错误;
B.氯化铝溶液中滴入过量的NaF溶液可以生成络合物--Na3AlF6,故B正确;
C.若由H、N、F组成盐为NH4F,其水溶液呈酸性,说明铵根离子水解程度大于氟离子水解程度,则溶液中该盐阳离子浓度小于酸根离子浓度,故C错误;
D.键能影响物质的稳定性,不能影响沸点,NH3沸点远高于NF3,应是NH3分子值存在氢键所致,故D错误,
故选B.
点评:本题考查结构性质位置关系应用,推断元素是解题的关键,B选项中学教材较少涉及,可以用排除法解答,难度中等.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
 在容积为2L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、该反应前5min的平均速率:v(N)=0.002mol?L-1?min-1 | ||
| C、在5min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | ||
| D、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、2g H218O中含有NA个中子 |
| B、标准状况下,14g CO气体中含有的原子数为0.5NA |
| C、0.1mol NH3分子中含有0.9NA个电子 |
| D、2.24L CH4气体中所含原子数为0.5NA |
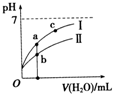 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
关于下列实验的叙述中正确的是( )
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |
某同学设计如图元素周期表,以下说法正确的是( )
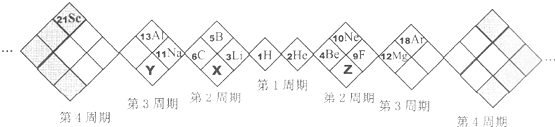

| A、X、Y、Z元素分别为N、P、O |
| B、白格中都是主族元素,灰格中都是副族元素 |
| C、原子半径:Z>X>Y |
| D、X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
2SO2+O2
2SO3是制造硫酸的重要反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |