题目内容
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据硫元素守恒计算物质的量分析;
B、氨气和氯化氢反应生成固体氯化铵;
C、依据反应前后元素化合价变化分析计算电子转移数;
D、溶液PH计算氢离子浓度,结合离子积常数计算氢氧根离子浓度,n=CV=
计算微粒数.
B、氨气和氯化氢反应生成固体氯化铵;
C、依据反应前后元素化合价变化分析计算电子转移数;
D、溶液PH计算氢离子浓度,结合离子积常数计算氢氧根离子浓度,n=CV=
| N |
| NA |
解答:
解:A、依据硫元素守恒计算物质的量=
=0.2mol,其中所含硫原子数一定为0.2NA,故A正确;
B、氨气和氯化氢反应生成固体氯化铵,故B错误;
C、依据反应前后元素化合价变化分析计算电子转移数,氯元素化合价+7价变化为0价,-1价变化为0价,每生成4mol Cl2转移的电子数为7NA ,故C错误;
D、溶液PH计算氢离子浓度为10-13mol/L,结合离子积常数计算氢氧根离子浓度=
=0.1mol/L,n=CV=
计算微粒数=0.1mol/L×1.0L×NA=0.1NA,故D错误;
故选A.
| 6.4g |
| 32g/mol |
B、氨气和氯化氢反应生成固体氯化铵,故B错误;
C、依据反应前后元素化合价变化分析计算电子转移数,氯元素化合价+7价变化为0价,-1价变化为0价,每生成4mol Cl2转移的电子数为7NA ,故C错误;
D、溶液PH计算氢离子浓度为10-13mol/L,结合离子积常数计算氢氧根离子浓度=
| 10-14 |
| 10-13 |
| N |
| NA |
故选A.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,溶液中离子浓度计算,注意氨气和氯化氢反应生成氯化铵,题目难度中等.

练习册系列答案
相关题目
化学与能源开发、环境保护、资源利用等密切相关.下列有关说法不正确的是( )
| A、将开采出的煤通过干馏、气化、液化等多种途径实现其综合利用 |
| B、氢气是清洁能源,工业上可用电解水法来开发氢能源 |
| C、向污水中投放明矾,利用生成的胶体净水:Al3++3H2O?Al(OH3)(胶体)+3H+ |
| D、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
下列对生产、生活有关化学问题的分析正确的是( )
| A、医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 |
| B、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝 |
| C、侯氏制碱是将先将CO2通入饱和氯化钠溶液中,然后通入NH3得碳酸氢钠固体,再灼烧制碳酸钠 |
| D、血液透析是利用了胶体的性质 |
下列叙述正确的是( )
| A、将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生沉淀 |
| B、称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,充分反应后放出氢气的体积(同温同压下)相等 |
| C、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中滴入Ba(OH)2溶液出现白色沉淀 |
| D、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则原溶液中一定含有SO42- |
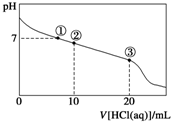 常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点①所示溶液中:c(CH3COOH)=c(Cl-)>c(Na+)>c(OH-)=c(H+) |
| B、点②所示溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH) |
| C、点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D、整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
下列说法不正确的是( )
| A、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
| B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜 |
| C、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 |
| D、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净 |
对反应A+3B?2C来说,下列反应速率最快的是( )
| A、v(A)=0.3 mol/(L?min) |
| B、v(A)=0.01 mol/(L?s) |
| C、v(C)=0.5 mol/(L?min) |
| D、v(B)=0.6 mol/(L?min) |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A、原子半径:Z<Y<W,而离子半径:W<Y<Z |
| B、W的氯化物水瑢液中滴加过量Z与钠形成的饱和溶液,可生成W配合物 |
| C、若由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 |
| D、已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
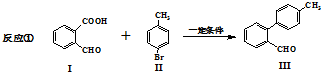
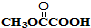 与
与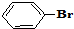 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为