题目内容
16.下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是( )①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤Cl2、H2.
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
分析 前者在一定的条件下能将后者从其化合物中置换出来,则前后的金属性大于后者或前者的氧化性大于后者,以此来解答.
解答 解:①Al比Fe活泼,Al能与氯化亚铁反应置换出Fe,故正确;
②Cl2的氧化性大于S,氯气与硫化氢反应置换出S,故正确;
③Mg的还原性大于C,则Mg与二氧化碳发生置换反应生成C,故正确;
④H2与CuO发生置换反应生成Cu,故正确;
⑤Cl2不能通过置换反应生成H2,故错误;
故选C.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重氧化还原反应、置换反应的应用能力考查,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
6.实验室用纯溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作进行提纯.正确的操作顺序是( )
①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗.
①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗.
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |
4.碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如图:
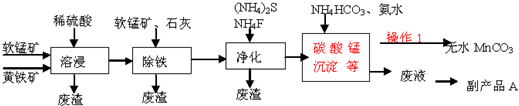
已知:几种金属离子沉淀的pH如表:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.

已知:几种金属离子沉淀的pH如表:
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.加压 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+═2Fe3++15Mn2++4SO42ˉ+14H2O
(3)操作1经过滤、洗涤(填操作名称)烘干等过程可得到无水碳酸锰.
(4)①除铁工序中,先加入适量的软锰矿,其作用是除去可能未被完全氧化的Fe2+,如何检验溶液中的Fe2+已被完全氧化?加入酸性高锰酸钾溶液,观察是否褪色
②再加入石灰调节溶液pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
(6)黄铁矿(主要成分是FeS2)还可以用来制备化工原料FeSO4,FeSO4可转化为FeCO3,
FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | 实验室制备氢氧化铁胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO22-+2H2O | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
8.已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是( )
| A. | 水的电离程度始终增大 | |
| B. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O}$先增大再减小 |
5.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |