题目内容
6.FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.(已知25℃Ksp[Fe(OH)3]=4.010-38 lg2=0.3 )请回答下列问题:
(1)FeCl3 净水的原理是Fe3++3H2O=Fe(OH)3胶体+3H+.(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为2.5×10-5(填写数值).
(2)将FeCl3 溶液与NaHCO3溶液混合,其离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
(3)25℃时pH=3的溶液中,c(Fe3+)=4×10-5mol•L-1要使Fe3+沉淀完全,pH应大于3.2
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+ K1
Fe(OH)2++H2O?Fe(OH)2++H+ K2
Fe(OH)++H2O?Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是K1>K2>K3.
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O?Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号)bd.
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5)FeCl3溶液可腐蚀印刷电路板,其反应为Cu+2FeCl3═CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为2Fe3++2e-=2Fe2+.
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;由Fe3++3H2O=Fe(OH)3胶体+3H+,K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,分析解答;
(2)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
(3)据氢氧化铁的溶度积常数和Fe3+沉淀完全的浓度为c(Fe3+)<10-5mol•L-1,计算氢氧根离子浓度得到溶液最小pH;
(4)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;
控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
(5)正极上铁离子得电子发生还原反应,其正极电极反应式为极:2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,离子方程式为:Fe3++3H2O=Fe(OH)3胶体+3H+,K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{{K}_{w}^{3}}{Ksp[Fe(OH)_{3}]}$=$\frac{(1×1{0}^{-14})^{3}}{4×1{0}^{-38}}$=2.5×10-5,故答案为:Fe3++3H2O=Fe(OH)3胶体+3H+;2.5×10-5;
(2)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,
故答案为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(3)25℃时pH=3的溶液中,c(Fe3+)=$\frac{4×1{0}^{-38}}{(1{0}^{-11})^{3}}$=4×10-5;常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol•L-1;
Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=4×10-38
c(OH-)=10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,
溶液PH=3.2;
故答案为:4×10-5;3.2;
(4)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;
控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;
故答案为:K1>K2>K3;bd;
(5)正极上铁离子得电子发生还原反应,其正极电极反应式为极:2Fe3++2e-=2Fe2+,故答案为:2Fe3++2e-=2Fe2+.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.

 名校课堂系列答案
名校课堂系列答案①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤Cl2、H2.
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
| A. | NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
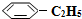 )可生产塑料单体苯乙烯(
)可生产塑料单体苯乙烯(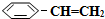 ),其原理反应是:
),其原理反应是: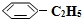 (g)?
(g)?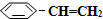 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.某温度下,将0.40mol
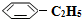 (g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
n(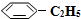 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(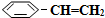 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应).
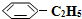 (g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动
(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动(3)在相同条件下,若最初向该容器中充入
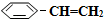 (g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下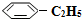 (g)和
(g)和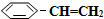 (g)的浓度c随时间t变化的曲线.
(g)的浓度c随时间t变化的曲线.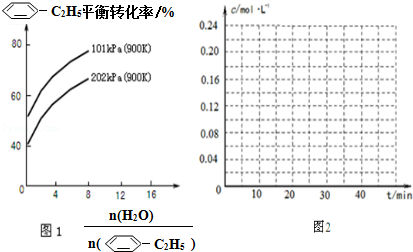
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 天津港爆炸事件中可知,当电石、钠、氰化钠等物品遇到明火时,应迅速用水浇灭 | |
| C. | 新发现一种固态碳,外形似海绵,密度小,有磁性,其与金刚石的关系是同素异形体 | |
| D. | 热的纯碱溶液去除厨房油污效果比冷的纯碱溶液效果好 |
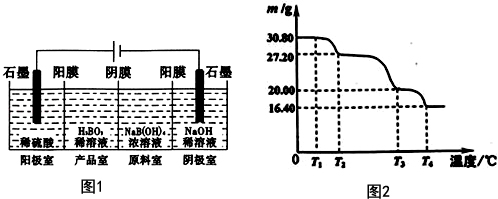 硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3.