题目内容
1.下列表示对应化学反应的离子方程式正确的是( )| A. | 实验室制备氢氧化铁胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO22-+2H2O | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.铁离子水解制备胶体;
B.反应生成硝酸铜、二氧化氮和水;
C.一水合氨在离子反应中保留化学式,反应生成硫酸铵、氢氧化铝;
D.至沉淀的物质的量最大,生成硫酸钡、氢氧化铝.
解答 解:A.实验室制备氢氧化铁胶体的离子反应为Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A正确;
B.金属铜与浓硝酸反应的离子反应为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故B错误;
C.向硫酸铝溶液中滴加过量的氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故C错误;
D.往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大的离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、水解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
11.据新闻网报道:科学家首次合成第117号元素,被美国《时代》周刊评选为当年十大科学发现.假如第117号元素符号暂时定为Up,下列关于${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up的说法中正确的是( )
| A. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up是两种元素 | |
| B. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up互为同位素 | |
| C. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up质子数不同、中子数相同 | |
| D. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up质量数相同、电子数不同 |
12.CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品.
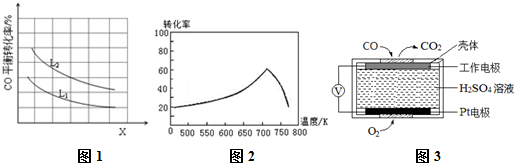
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
①反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是温度;a<0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-748kJ•mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低.
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为CO-2e-+H2O═CO2+2H+;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+.
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)?CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)..

(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是温度;a<0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-748kJ•mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低.
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为CO-2e-+H2O═CO2+2H+;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+.
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)?CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)..
9.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol 氖气含有的原子数为2NA | |
| C. | 27g Al与足量的盐酸反应失去的电子数为3NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数一定相同 |
16.下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是( )
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤Cl2、H2.
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤Cl2、H2.
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
6.实验室中保存金属钠的方法是( )
| A. | 放在水中 | B. | 放在四氯化碳中 | C. | 放在石蜡油中 | D. | 放在细沙中 |
13.科学家提出可以用酸度(AG) 表示溶液的酸碱性,AG=lg$\frac{c{(H}^{+})}{c({OH}^{-})}$,下列叙述正确的是( )
| A. | 中性溶液的AG=1 | |
| B. | 常温下0.1 mol•L-1NaOH溶液的AG=12 | |
| C. | 酸性溶液的AG<0 | |
| D. | 常温下0.1 mol•L-1盐酸溶液的AG=12 |
10.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定大量共存的是( )
| A. | NH4+、I-、CO32-、Fe3+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Mg2+、Cl-、Ca2+ | D. | K+、Na+、Cl-、SO42- |