题目内容
7.归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)═c(OH-)+c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④若将适量CO2 通入0.1mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+c(HCO3ˉ)=0.1mol•L-1
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw.
| A. | ①②④⑤ | B. | ②④ | C. | ②⑤ | D. | ①②③④ |
分析 ①可逆反应达到平衡时,减少生成物浓度,平衡向着正向移动,但是生成物浓度减小;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
③相同温度下,溶液中氯离子浓度越大该溶液抑制AgCl溶解程度越大;
④任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,Kw=c(H+).c(OH-).
解答 解:①可逆反应达到平衡时,减少生成物浓度,平衡向着正向移动,但是生成物浓度减小,所以平衡正向移动生成物百分含量不一定增大,故错误;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故正确;
③相同温度下,溶液中氯离子浓度越大该溶液抑制AgCl溶解程度越大,相同浓度的氯化钙和氯化钠中,氯化钙中氯离子浓度大于氯化钠,所以AgCl在同浓度的氯化钙中溶解度小于氯化钠溶液中,故错误;
④溶液呈中性,则存在c(H+)=c(OH-),任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得2c(CO32ˉ)+c(HCO3ˉ)=c(Na+)=0.2mol•L-1,故错误;
⑤电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$,Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,Kw=c(H+).c(OH-),所以存在Ka•Kh=Kw,故正确;
故选C.
点评 本题考查较综合,涉及化学平衡、弱电解质的电离、盐类水解、难溶物溶解平衡等知识点,为高频考点,明确电解质电离特点、难溶物溶解平衡影响因素等知识点是解本题关键,难点是⑤中这几个平衡常数之间关系,题目难度不大.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案| A. | HCl | B. | Ca(HCO3)2溶液 | C. | FeCl3 | D. | CuSO4 |
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为-285.8 kJ•mol-1 | |
| D. | O2前面的表示参加反应的O2的分子数目 |
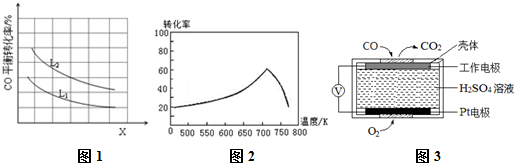
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是温度;a<0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-748kJ•mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低.
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为CO-2e-+H2O═CO2+2H+;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+.
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)?CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)..
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤Cl2、H2.
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
| A. | NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
