题目内容
1.亚铁氰化钾(K4Fe(CN)6,黄血盐)在化学实验、电镀、食品添加剂及医学上有广泛用途.还可用于冶疗铊(Tl)中毒,烧制青花瓷时可用于绘画等.已知HCN是一种极弱的酸.现有一种用含NaCN废水合成黄血盐的主要工艺流程如图: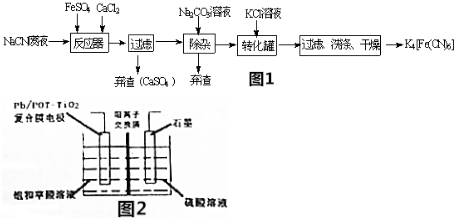
(1)实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、漏斗、铁架台.
(3)流程图中加入碳酸钠溶液的主要目的是除去其中的Ca2+.
(4)烧制青花瓷时,瓷器表面的暗红色涉及辉铜矿制取铜的反应.其过程如下:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol.
(5)工业上常用草酸(H2C2O4)来洗涤反应后的转化罐,草酸也可以用于制备高档香料乙醛酸(H2C2O3),装置如图2所示,写出复合膜电极的电极反应式HOOCCOOH+2H++2e-═OHCCOOH+H2O.
(6)环保局对某电镀厂排放的NaCN溶液,进行检测.取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化,用滴定管加入过量的0.10mol/L的H2O2共计15mL,产生两种无毒气体,请写出该离子反应方程式2H++2CN-+5H2O2=N2+2CO2+6H2O;
再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,该废水NaCN的浓度为0.98g/L.(已知废水中的杂质不参与反应)
分析 实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O?HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中;
(2)依据过滤装置选择所需玻璃仪器;
(3)反应器中加入氯化钙,需要加入碳酸钠除去;
(4)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
依据盖斯定律计算(①+②)×$\frac{1}{3}$得到由Cu2S与O2加热反应生成Cu的热化学方程式;
(5)草酸(HOOCCOOH)在阴极上得电子生成OHCCOOH,阳极上氢氧根离子失电子生成氧气,电池总反应为2HOOCCOOH═2OHCCOOH+O2↑;
(6)取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化得到的氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,依据原子守恒书写化学方程式;高锰酸钾溶液氧化过氧化氢生成氧气,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,计算剩余过氧化氢,得到与NaCN反应的过氧化氢来计算NaCN物质的量,计算得到溶液浓度.
解答 解:实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+,经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6,说明K4[Fe(CN)6溶解度较小,
(1)NaCN为强碱弱酸盐,溶液中CN-离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN-+H2O?HCN+OH-,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,
故答案为:NaOH;
(2)流程中经过滤、洗涤、干燥后得到K4[Fe(CN)6].过滤实验中使用的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(3)反应器中加入氯化钙,加入碳酸钠溶液可除去过量的Ca2+,
故答案为:除去其中的Ca2+;
(4)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJ/mol
②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJ/mol
依据盖斯定律计算(①+②)×$\frac{1}{3}$得到由Cu2S与O2加热反应生成Cu的热化学方程式为:Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol,
故答案为:Cu2S(s)+O2(g)=)=2Cu(s)+SO2(g)△H=-652.2KJ/mol;
(5)草酸(HOOCCOOH)在阴极上得电子生成OHCCOOH,阴极反应式为:HOOCCOOH+2H++2e-═OHCCOOH+H2O,
故答案为:HOOCCOOH+2H+OHCCOOH+H2O;
(6)取NaCN废液1L,浓缩到20mL,加入适量硫酸酸化得到的氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,反应的离子方程式为:2H++2CN-+5H2O2=N2+2CO2+6H2O,再用0.02mol/L的酸性KMnO4溶液滴定过程的H2O2,实验测得消耗KMnO4溶液的平均值为10.00mL,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
2 5
0.02mol/L×0.010L n
n=0.0005mol,
与NaCN反应的过氧化氢物质的量=0.10mol/L×0.015L-0.0005mol=0.001mol
2CN-+5H2O2=N2+2CO2+6H2O
2 5
n(NaCN) 0.001mol
n(NaCN)=0.0004mol,
该废水NaCN的浓度=$\frac{0.0004mol×49g/mol}{0.020L}$=0.98g/L
故答案为:2H++2CN-+5H2O2=N2+2CO2+6H2O;0.98.
点评 本题考查了热化学方程式书写、盐类水解的原理分析、电解池电极反应、滴定实验的计算分析、离子方程式书写等知识点,题目难度中等.

| A. | 氢气 | B. | 氮气 | C. | 氧气 | D. | 氨气 |
| A. | 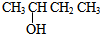 的名称为2-羟基丁烷 的名称为2-羟基丁烷 | |
| B. | 乙酸、乙酸乙酯和淀粉的最简式均为CH2O | |
| C. | (CH3)3CCH2C(CH3)=CH2的名称为 2,2,4-三甲基-1-戊烯 | |
| D. | 按系统命名法CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| A. | 除去溴苯中的溴,可加入过量的KI溶液后分液 | |
| B. | 葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 | |
| C. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 | |
| D. | 纤维素属于高分子化合物,与淀粉互为同分异构体 |
| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |
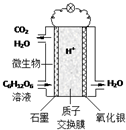 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
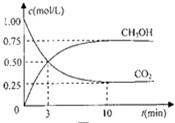 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,