题目内容
下列推断或表述正确的是( )
| A、25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合液滴加1~2滴0.01 mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C、0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)═c(OH-)+c(X-) |
| D、25°时,0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A.加水稀释醋酸中的氢离子浓度减小;
B.沉淀呈黄色,说明AgI溶解度较小;
C.根据电荷守恒分析;
D.0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后酸过量,计算剩余的H+离子浓度.
B.沉淀呈黄色,说明AgI溶解度较小;
C.根据电荷守恒分析;
D.0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后酸过量,计算剩余的H+离子浓度.
解答:
解:A.25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,醋酸中的氢离子浓度减小,pH增大,所以a<b,故A错误;
B.沉淀呈黄色,说明AgI先析出,则AgI溶解度较小,则AgCl的Ksp比AgI的Ksp大,故B错误;
C.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则有:c(H+)+c(K+)═c(OH-)+c(X-),故C正确;
D.0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后酸过量,c(H+)=
=0.05mol/L,则pH不为1,故D错误.
故选:C.
B.沉淀呈黄色,说明AgI先析出,则AgI溶解度较小,则AgCl的Ksp比AgI的Ksp大,故B错误;
C.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则有:c(H+)+c(K+)═c(OH-)+c(X-),故C正确;
D.0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后酸过量,c(H+)=
| 0.2mol/L×V-0.05mol/L×2×V |
| 2V |
故选:C.
点评:本题考查电解质在水中的电离、溶度积常数电荷守恒的应用等,明确稀释及混合时溶液中离子浓度的变化及计算即可解答,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| B、甲酸与乙二酸互为同系物 |
| C、用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质 |
D、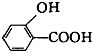 (水杨酸)与足量的NaHCO3溶液反应可生成 (水杨酸)与足量的NaHCO3溶液反应可生成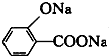 、CO2和H2O 、CO2和H2O |
有关如图装置的叙述不正确的是( )
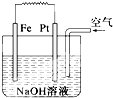

| A、这是电解NaOH溶液的装置 |
| B、该装置中Pt为正极,电极反应为O2+2H2O+4e-═4OH- |
| C、该装置中Fe为负极,电极反应为Fe-2e-═Fe2+ |
| D、这是一个原电池装置 |
滴加新制氯水后,下列各组离子可能大量存在的是( )
| A、Fe3+、Al3+、Cl-、SO42- |
| B、K+、Na+、SO32-、SO42- |
| C、Ag+、Ca2+、NH4+、NO3- |
| D、Na+、Ba2+、CO32-、SO42- |
将1mol某饱和醇分成两等份.其中一份充分燃烧后生成1.5mol CO2,另一份与足量钠反应生成5.6L H2(标准状况).这种醇分子结构中除羟基外,还有两种不同的氢原子.则这种醇是( )
A、 |
B、 |
| C、CH3CH2CH2OH |
| D、CH3CH2OH |
物质的量之比为2:5的锌与稀硝酸恰好完全反应,若硝酸被还原的产物为NH4NO3,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
| A、1:4 | B、1:9 |
| C、2:3 | D、2:5 |