题目内容
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流
一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.
请回答下列问题
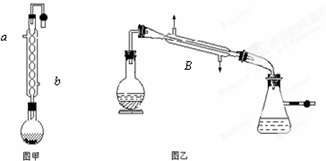
(1)图甲中冷凝水从 (a或b)进,图乙中B装置的名称为 .
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是 .
(3)反应中加入过量的乙醇,目的是 .
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
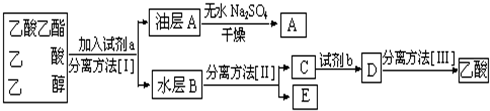
则试剂a是 ,分离方法I是 ,分离方法II是 ,产物E是 .
一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.

请回答下列问题
(1)图甲中冷凝水从
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是
(3)反应中加入过量的乙醇,目的是
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:

则试剂a是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)冷凝器进水为下口进上口出,B的名称是冷凝管;
(2)液体加热要加沸石或碎瓷片,防止暴沸;
(3)为了提高乙酸的转化率,实验时加入过量的乙醇;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸.
(2)液体加热要加沸石或碎瓷片,防止暴沸;
(3)为了提高乙酸的转化率,实验时加入过量的乙醇;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸.
解答:
解:(1)为了达到更好的冷凝效果,冷凝器进水为下口进上口出,B装置的名称为冷凝管,
故答案为:b;冷凝管;
(2)给混合液体加热时容易发生暴沸现象,通常加入加沸石或碎瓷片,可防止溶液暴沸,
故答案为:防止暴沸;
(3)酯化反应为可逆反应,增加一种反应物(非固体)的浓度可以增大另一种反应物的转化率,所以为了提高乙酸的转化率,实验时加入过量的乙醇,
故答案为:该反应为可逆反应,增大乙醇的量可以提高乙酸的转化率;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液(a),实现酯与乙酸和乙醇的分离;分离油层和水层采用分液的方法即可;对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏(Ⅱ)操作分离出E乙醇;然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏(Ⅲ)得到乙酸,
故答案为:饱和Na2CO3溶液;分液;蒸馏;乙醇.
故答案为:b;冷凝管;
(2)给混合液体加热时容易发生暴沸现象,通常加入加沸石或碎瓷片,可防止溶液暴沸,
故答案为:防止暴沸;
(3)酯化反应为可逆反应,增加一种反应物(非固体)的浓度可以增大另一种反应物的转化率,所以为了提高乙酸的转化率,实验时加入过量的乙醇,
故答案为:该反应为可逆反应,增大乙醇的量可以提高乙酸的转化率;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液(a),实现酯与乙酸和乙醇的分离;分离油层和水层采用分液的方法即可;对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏(Ⅱ)操作分离出E乙醇;然后水层中的乙酸钠,根据强酸制弱酸,要用硫酸反应得到乙酸,再蒸馏(Ⅲ)得到乙酸,
故答案为:饱和Na2CO3溶液;分液;蒸馏;乙醇.
点评:本题考查乙酸乙酯的制备、物质的分离与提纯等知识,题目难度中等,注意掌握酯化反应的制备装置及反应原理,明确分离混合物的操作步骤及实验评价的方法,(3)为易错点,注意明确反应物浓度对化学平衡的影响.

练习册系列答案
相关题目
下列推断或表述正确的是( )
| A、25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合液滴加1~2滴0.01 mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C、0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)═c(OH-)+c(X-) |
| D、25°时,0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
摩尔是( )
| A、国际单位制的一个基本物理量 |
| B、表示物质质量的单位 |
| C、计量微观粒子的物质的量的单位 |
| D、表示6.02×1023个粒子的集体 |
第一次用无机物制备有机物尿素,开辟人工合成有机物先河的科学家是( )
| A、德国的维勒 |
| B、英国的道尔顿 |
| C、德国的李比希 |
| D、俄罗斯的门捷列夫 |