题目内容
16.欲配制100mL 1.0mol/LNa2CO3溶液,正确的方法是( )| A. | 称量10.6 g Na2CO3溶于100 mL水中 | |
| B. | 称量10.6 g Na2CO3•10H2O溶于少量水中,再用水稀释至100 mL | |
| C. | 量取20 mL 5.0 mol/L Na2CO3溶液用水稀释至100 mL | |
| D. | 配制80 mL 1.0 mol/L Na2CO3溶液,则只需要称量8.5 g Na2CO3 |
分析 A.100mL为水的体积,不是溶液的体积;
B.结合n=$\frac{m}{M}$、c=$\frac{n}{V}$计算;
C.结合稀释前后溶质的物质的量不变计算;
D.配制80 mL 1.0 mol/L Na2CO3溶液,需要100mL容量瓶,结合m=cVM计算.
解答 解:A.100mL为水的体积,不是溶液的体积,则不能计算物质的量浓度,故A错误;
B.n=$\frac{m}{M}$=$\frac{10.6g}{286g/mol}$<0.1mol,由V=0.1L、c=$\frac{n}{V}$可知,碳酸钠溶液的浓度小于0.1mol/L,故B错误;
C.由稀释前后溶质的物质的量不变可知,稀释后c=$\frac{0.02L×5.0mol/L}{0.1L}$=1mol/L,故C正确;
D.配制80 mL 1.0 mol/L Na2CO3溶液,需要100mL容量瓶,碳酸钠的质量m=cVM=0.1L×1.0mol/L×106g/mol=10.6g,故D错误;
故选C.
点评 本题考查一定物质的量浓度溶液的配制,为高频考点,把握浓度、物质的量、体积的关系为解答的关键,侧重分析与实验能力的考查,注意溶液体积的判断及稀释前后溶质的物质的量不变,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.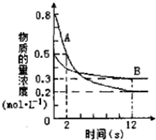 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
7.下列关于有机物的说法正确的是( )
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 70%-75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得乙酸、苯及甲苯 |
11.能证明碳酸酸性比硅酸酸性强的事实是( )
| A. | 碳酸能溶于水,硅酸不能 | |
| B. | CO2通入硅酸钠溶液后生成白色硅酸沉淀 | |
| C. | Na2CO3和SiO2高温反应生成Na2SiO3和CO2 | |
| D. | 盐酸和Na2CO3反应生成CO2,盐酸和Na2SiO3反应生成硅酸 |
1.可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质( )
①密度比空气的大 ②易液化 ③能溶于水 ④有毒.
①密度比空气的大 ②易液化 ③能溶于水 ④有毒.
| A. | ①④ | B. | ①② | C. | ③④ | D. | ①③④ |
8.在反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,当有6.3g硝酸被还原时,则参加反应的铜的量为( )
| A. | 0.15mol | B. | 0.0375mol | C. | 2.4g | D. | 19.2g |
5.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
 氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.
氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.