题目内容
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解质,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答 解:A、根据总反应可知Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,负极区PH减小,故A错误;
B、根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),故B错误;
C、原电池中,电子由负极经外电路流向正极,故C错误;
D、阳离子向正极移动,故D正确.
故选D.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断.

练习册系列答案
相关题目
1.下列气体中,不具有毒性的气体是( )
| A. | N2 | B. | Cl2 | C. | CO | D. | SO2 |
2.下列说法正确的是( )
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| B. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | H2S的水溶液中存在下列平衡:H2S?2H++S2- | |
| D. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
19.钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求.一种以Na2SO4水溶液为电解液的钠离子电池总反应为:
NaTi2(PO4)3+2Na2NiFeⅡ(CN)6 $?_{充电}^{放电}$ Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6
(注:其中P的化合价为+5,Fe的上标Ⅱ、Ⅲ代表其价态).下列说法不正确的是( )
NaTi2(PO4)3+2Na2NiFeⅡ(CN)6 $?_{充电}^{放电}$ Na3Ti2(PO4)3+2NaNiFeⅢ(CN)6
(注:其中P的化合价为+5,Fe的上标Ⅱ、Ⅲ代表其价态).下列说法不正确的是( )
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| C. | 充电过程中阳极反应式为:2NaNiFeIIⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ(CN)6 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
6.下列说法不正确的是( )
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| C. | 氢气之所以被称为“绿色能源”是因为它燃烧的产物不会污染环境 | |
| D. | 人类利用的能源都是通过化学反应获得的 |
16.下列说法正确的是( )
| A. | 二氧化硫具有还原性,能与强氧化性的高锰酸钾发生氧化还原反应 | |
| B. | 因为二氧化硫具有漂白性,能使品红溶液永久褪色 | |
| C. | 大气中二氧化碳浓度高时能形成酸雨 | |
| D. | 浓硫酸常用作干燥剂,因为浓硫酸具有脱水性 |
20.135℃,101.3kPa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下).若a=10时,该烃可能的分子式是( )
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
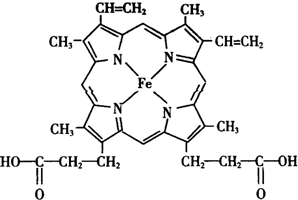 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: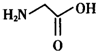 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.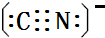 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).