题目内容
2.下列说法正确的是( )| A. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| B. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | H2S的水溶液中存在下列平衡:H2S?2H++S2- | |
| D. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
分析 A、根据公式N=nNA=cVNA,溶液体积未知,无法计算微粒数;
B、次氯酸根离子为弱酸根离子,水溶液中部分水解;
C、H2S是二元弱酸,所以在水溶液中的电离是分步进行的;
D、反应的熵变△S>0,△H<0,依据△H-T△S<0反应自发进行判断.
解答 解:A、溶液体积未知,无法计算氢氧根离子数目,故A错误;
B、次氯酸根离子为弱酸根离子,水溶液中部分水解,所以1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA,故B错误;
C、H2S是二元弱酸,所以在水溶液中的电离是分2步进行的,故C错误;
D、依据△H-T△S<0反应自发进行判断,反应的熵变△S>0,△H<0,△H-T△S一定小于0,反应一定自发进行,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断、弱电解质的电离以及反应自发进行的判据知识,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度中等.

练习册系列答案
相关题目
12.下列粒子既有氧化性,又有还原性的是( )
| A. | Cl- | B. | Fe2+ | C. | Cu2+ | D. | Al |
13.下列说法正确的是( )
| A. | 通式为CnH2n的烃一定能使酸性高锰酸钾溶液褪色 | |
| B. | 通式为CnH2n-2的烃一定是炔烃 | |
| C. | 分子式为C4H8的烃不一定能使溴水褪色 | |
| D. | 芳香烃的通式为CnH2n-6(n≥6) |
17. 某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
 某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解质,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
| A. | 电池工作时,Zn为负极,负极区PH变大 | |
| B. | 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极流向负极 | |
| D. | 电解质氢氧化钾溶液中阳离子迁移到电池的正极 |
12.亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6.下列判断错误的是( )
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
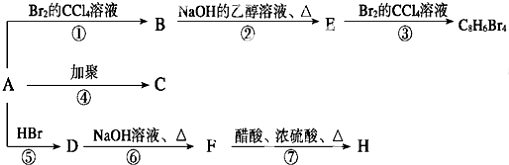
 .
. ;E:
;E: .
. .
.
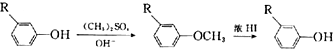
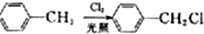
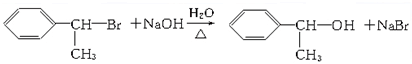
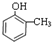 ;E→F的反应类型为取代反应.
;E→F的反应类型为取代反应.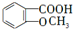 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$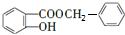 +HCl
+HCl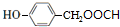 (写结构简式).
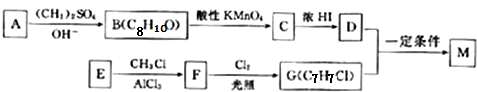
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备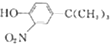 的合成路线:
的合成路线: $→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$
$→_{AlCl_{3}}^{(CH_{3})_{3}CCl}$ $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$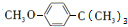 $→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$
$→_{浓H_{2}O_{4}/△}^{浓HNO_{3}}$ $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$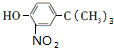 .
.