题目内容
1.下列各项与化学平衡移动原理无关的是( )| A. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| B. | 收集氯气用排饱和食盐水的方法 | |
| C. | 加压条件下有利于SO2和O2反应生成SO3 | |
| D. | 可用浓氨水和氢氧化钠固体快速制取氨气 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A.催化剂只改变化学反应速率,但不影响平衡移动,所以不能用平衡移动原理解释,故A选;
B.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?HClO-+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以平衡移动原理解释,故B不选;
C.增大压强,平衡向正反应方向移动,能用平衡移动原理解释,故C不选;
D.浓氨水加入氢氧化钠固体,氢氧化钠固体溶解放热,使一水合氨分解生成氨气的化学平衡NH3+H2O?NH3•H2O?NH4++OH-,逆向进行,能用化学平衡移动原理解释,故D不选;
故选A.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生对化学平衡移动原理的理解和判断,只有能引起平衡移动的才能用平衡移动原理解释,否则不能用平衡移动原理解释.

练习册系列答案
相关题目
14.下列晶体性质的比较中正确的是( )
| A. | 沸点:NH3>H2O>HF | B. | 熔点:金刚石>碳化硅>晶体硅 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4<SiBr4<SiCl4 |
9.某同学用某种粗盐进行提纯实验,步骤见图.
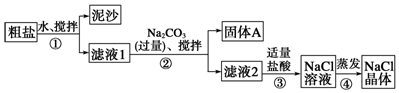
请回答下列问题:
(1)步骤①和②的操作名称是过滤.
(2)步骤③判断加入盐酸“适量”的方法是滴加盐酸至无气泡产生为止;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止溶液飞溅,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:

请回答下列问题:
(1)步骤①和②的操作名称是过滤.
(2)步骤③判断加入盐酸“适量”的方法是滴加盐酸至无气泡产生为止;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止溶液飞溅,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干.
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | Ⅰ有气泡放出,澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入Ⅱ稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | Ⅲ猜想Ⅱ不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,Ⅳ滴入BaCl2溶液和稀HNO3溶液 | Ⅴ有白色沉淀且不溶于稀HNO3 | 猜想Ⅲ成立 |
16.在同温同压下时,11.2L二氧化碳和11.2L氧气所含氧原子数( )
| A. | 相等 | B. | 前者多 | C. | 后者多 | D. | 无法确定 |
6.下列说法中正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
13.下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
| 序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
10.硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是( )
| A. | 难氧化 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 属于混合物 |