题目内容
13.下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )| 序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
分析 ①生成KCl,引入新杂质;
②铁可置换出铜;
③二氧化碳与氢氧化钠溶液反应;
④碳酸钙不溶于水.
解答 解:①加入氯化铁,生成KCl,引入新杂质,应加入硝酸铁除杂,故错误;
②铁可置换出铜,可除去杂质,故正确;
③二氧化碳与氢氧化钠溶液反应,可除去杂质,干燥后得到纯净的氢气,故正确;
④碳酸钙不溶于水,可用过滤的方法除去,故正确.
故选C.
点评 本题考查物质的分离,提纯,为高频考点,把握混合物分离提纯实验、实验基本操作和基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.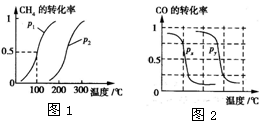 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为l00L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)
I.CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD(填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了如表的实验设计表中.如表中剩余的实验条件数据:
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
b.根据反应Ⅱ的特点,如图2是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.
4.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
1.下列各项与化学平衡移动原理无关的是( )
| A. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| B. | 收集氯气用排饱和食盐水的方法 | |
| C. | 加压条件下有利于SO2和O2反应生成SO3 | |
| D. | 可用浓氨水和氢氧化钠固体快速制取氨气 |
8.下列电离方程式中,正确的是( )
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
18.无机化合物可根据其组成和性质进行分类,
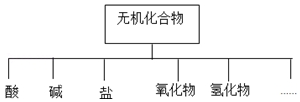
(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
(3)SO2和CO2都属于酸性氧化物,在化学性质上有很多相似的地方,请写出少量的⑦与③反应的化学反应方程式为:SO2+2NaOH=Na2SO3+H2O.
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于正盐盐(填正盐、酸式盐或碱式盐).

(1)如图所示的物质分类方法名称是树状分类法.
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在表中②、④、⑥、⑩后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧ | ⑨NH3 ⑩ |
(4)磷的一种化合物叫亚磷酸(H3PO3),从交叉分类的角度看,它属于二元弱酸,则Na2HPO3属于正盐盐(填正盐、酸式盐或碱式盐).
5. 中和滴定的相关问题
中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
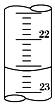
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是ACD(填字母).
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
 中和滴定的相关问题
中和滴定的相关问题Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是ab(填字母).
(2)下列操作合理的是AD(填字母).
A.用25mL碱式滴定管量取20.00mL NaOH溶液
B.用托盘天平准确称量10.20g碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.用500mL容量瓶配制1mol•L-1的氢氧化钠溶液495.5mL
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答下列问题:
(1)以上步骤有错误的是①(填编号).
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为浅红色,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(4)根据下列数据,请计算待测盐酸的浓度:0.2000mol•L-1.
| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液.
3.下列同学的饮食习惯科学的是( )
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为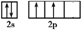 .
.