题目内容
16.在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故.(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是第三周期ⅦA族.
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
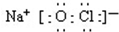 .
.(3)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-.常温下HClO的电离平衡常数为10-6.4.洁厕液与84消毒液混合后会生成有毒的氯气.写出该反应的离子方程式ClO-+Cl-+2H+=Cl2↑+H2O.
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用d溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇.
分析 (1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,以此可确定在周期表中的位置;
(2)根据次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对;
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,电离平衡常数K=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$,依据水解平衡常数和溶液中离子积常数计算,洁厕液与84消毒液混合后会生成有毒的氯气,是洁厕净中盐酸和84消毒液中氯离子、次氯酸根离子发生氧化还原反应生成氯气;
(4)①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,结合电荷守恒和原子守恒配平书写离子方程式;
②选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.
解答 解:(1)氯的原子序数为17,原子核外有3个电子层,最外层电子数为7,则应位于周期表第三周期ⅦA族,
故答案为:第三周期ⅦA 族;
(2 )次氯酸钠是离子化合物,氧原子和氯原子共用1对共用电子对,电子式为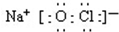 ,
,
故答案为: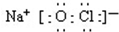 ;
;
(3)常温下,0.1mol/L的NaClO溶液的pH=9.7,溶液显碱性,次氯酸钠溶液中次氯酸根离子水解显碱性,反应的离子方程式为:ClO-+H2O?HClO+OH-,常温下,0.1mol/L的NaClO溶液的pH=9.7,ClO-+H2O?HClO+OH-,Kh=$\frac{c(O{H}^{-})c(HClO)}{c(Cl{O}^{-})}$=$\frac{Kw}{Ka}$,则Ka=$\frac{1{0}^{-14}}{0.1×1{0}^{-4.3}}$═10-6.4,
次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:次氯酸根离子水解溶液显碱性,ClO-+H2O?HClO+OH-;10-6.4;ClO-+Cl-+2H+=Cl2↑+H2O;
(4)①在碱性条件下,NaClO氧化硝酸铁制得Na2FeO4,利用化合价升降法配平,该反应的离子反应方程式为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
②K2FeO4 在水溶液中水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤,
a.H2O不能抑制水解,容易损失,故a错误;
b.NH4Cl、异丙醇,促进水解,故b错误;
c.Fe(NO3)3、异丙醇,促进水解,个c错误;
d. CH3COONa、异丙醇,能抑制水解,减少洗涤损失,故d正确,故选d,
故答案为:d.
点评 本题考查较综合,侧重于学生的分析能力及应用能力的考查,为高考常见题型,注意把握物质的性质、盐类水解及氧化还原反应为解答该类题目的关键,题目难度中等.

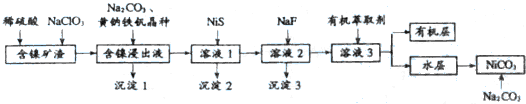
已知:(Ⅰ)含镍浸出液的成分及离子沉淀的pH:
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
(2)黄钠铁钒[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速度快,容易过滤等特点,常用于除铁.写出流程中第一次加入 Na2CO3溶液时反应的离子方程式:Na++3Fe3++2SO42-+3H2O+3CO32-=NaFe3(SO4)2(OH)6↓+3CO2↑;
(3)NiS的作用是除去溶液中的Cu2+,原理是NiS+Cu2+═CuS+Ni2+,该反应的平衡常数是8.43×104;
(4)滤液2中加入NaF的作用是除去溶液中的Ca2+、Mg2+,则加入NaF先沉淀的离子是Mg2+.
(5)NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由NiCO3为原料获得,结合上述流程,制备NiSO4•6H2O的操作步骤如下:
①向被有机萃取剂萃取后所得的水层中加入足量Na2CO3溶液(流程中第二次加Na2CO3溶液),搅拌,得NiCO3沉淀:
②过滤,并用蒸馏水洗涤沉淀2-3次直至流出液用pH试纸检验呈中性;
③向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解;
④蒸发、冷却结晶并从溶液中分离出晶体;
⑤用少量乙醇洗涤并晾干.
确定步骤①中Na2CO3溶液足量,碳酸镍己完全沉淀的简单方法是:上层清液呈无色(或静置后向上层液中再加入Na2CO3溶液后没有沉淀生成);
补充完整上述步骤②和③【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】.
| A. | 用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 将钢闸门与电源正极相连,可防止其在海水中被腐蚀 | |
| D. | 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同 |
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| B | 向盛有Fe(NO3)2溶液的试管中加入1mol/LH2SO4 | 若试管口出现红棕色气体,说明NO3-被Fe2+还原为NO |
| C | 淀粉碘化钾溶液久置显蓝色 | 是由于I-被还原,析出的I2溶于溶液中 |
| D | 向含有少量的FeBr3的FeCl3溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl3溶液中的FeBr3 |
| A. | A | B. | B | C. | C | D. | D |
①Fe+Cu2+═Fe2++Cu
②Al3++3NH3•H2O═Al(OH)3↓+3NH4+
③Cl2+H2O?H++Cl-+HClO
④CaCO3+2H+═Ca2++CO2↑+H2O
⑤Ag++Cl-═AgCl↓
| A. | ③⑤ | B. | ②③ | C. | 只有③ | D. | ①④ |
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |