题目内容
7.下列说法正确的是( )| A. | 用KSCN溶于检验Fe2(SO4)3溶液中是否含有FeSO4 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 将钢闸门与电源正极相连,可防止其在海水中被腐蚀 | |
| D. | 浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同 |
分析 A.硫酸亚铁与KSCN不反应;
B.同位素由同种元素构成,同位素混合为混合物;
C.阳极发生氧化反应;
D.浊液、胶体、溶液三种分散系的分散质的粒子直径大小不同.
解答 解:A.硫酸亚铁与KSCN不反应,应用溴水、高锰酸钾等检验,故A错误;
B.同位素由同种元素构成,同位素混合为混合物,如氧气和臭氧,故B错误;
C.连接电源正极,为电解池的阳极,阳极发生氧化反应,不能防止腐蚀,故C错误;
D.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),故D正确.
故选D.
点评 本题考查较为综合,涉及物质的检验、金属的腐蚀以及分散系等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的可行性的评价,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.下列各组物质中,互为同素异形体的是( )
| A. | 甲烷和乙烷 | B. | 丙烯和环丙烷 | C. | 金刚石和石墨 | D. | 35Cl 和37Cl |
2.下列说法中,错误的是( )
| A. | 人类目前所利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 我国目前最主要的能源是石油 | |
| D. | 能量变化是化学反应的基本特征之一 |
12.下列图①~④分别与相应的操作过程相对应,其中正确的是( )
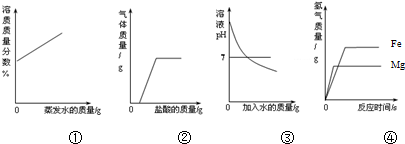

| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
19.下列有关实验操作的叙述错误的是( )
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| C. | 中和滴定时.滴定管用所盛装的反应液润洗2~3 次. | |
| D. | 分液操作中,下层液体从下端放出,上层液体从上口倒出 |
 .
.