题目内容
6. 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.请填空:
(1)A管的作用是调节水面的高度来控制反应的发生和停止,制取乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是高锰酸钾溶液褪色,乙炔发生了氧化反应.
(3)乙炔通入溴水的CCl4溶液中观察到的现象是溴的四氯化碳溶液褪色.
(4)为了安全,点燃乙炔前应检查乙炔的纯度,乙炔燃烧时的实验现象是明亮火焰并伴有浓烈的黑烟.
分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;
(3)关键乙炔与溴发生加成反应进行判断;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸;因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:高锰酸钾溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,导致溴的四氯化碳溶液褪色,故答案为:溴的四氯化碳溶液褪色;
(4)乙炔燃烧的化学方程式为 2CH≡CH+5O2 $\stackrel{点燃}{→}$4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,
故答案为:检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟.
点评 本题考查乙炔的制取及化学性质、常见物质的制备方法,为高频考点,题目难度中等,注意掌握常见有机物的结构和性质,明确有机物的合成方案的设计方法.

练习册系列答案
相关题目
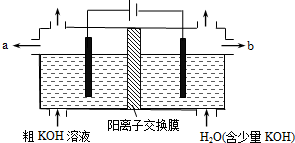
16.用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示.下列有关说法错误的是
 ( )
( )
 ( )
( )| A. | 阳极反应式为4OH--4e-=2H2O+O2↑ | B. | 通电后阴极区附近溶液pH会增大 | ||
| C. | K+通过交换膜从阴极区移向阳极区 | D. | 纯净的KOH溶液从b出口导出 |
17.a、b、c、d四种元素在周期表中的位置如图,则下列说法正确的是( )


| A. | 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3 | |
| B. | 若b的单质可作半导体材料,则c的单质不可能为半导体材料 | |
| C. | 若b的单质与H2易化合,则c的单质与H2更易化合 | |
| D. | a与b之间容易形成离子化合物 |
14.化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
| A. | 除去CuSO4溶液中的Fe(SO4)3,加入足量CuO粉末,充分搅拌过滤 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 铁管道与直流电源正极相连,可缓解管道腐蚀 |
1.利用下列表格中的器材和试剂能够完成相应实验的是 ( )
| 选项 | 器材和试剂 | 相应实验 |
| A | 洗气瓶,饱和Na2CO3溶液、浓硫酸、含HCl和水蒸气的CO2气体 | 除去CO2中的HCl和水蒸气 |
| B | 分液漏斗、烧杯、蒸馏水、溴和苯的混合物 | 分离溴和苯的混合物 |
| C | 铁架台、试管、带导管的单孔塞、浓硫酸、铜片 | 实验室制取SO2 |
| D | 铁架台、试管、带导管的单孔塞、棉花、酒精灯、氯化铵晶体、熟石灰 | 实验室制取NH3 |
| A. | A | B. | B | C. | C | D. | D |
4.下列实验过程中,始终无明显现象的是( )
| A. | O2通入酸化的KI淀粉溶液中 | |
| B. | CO2通入CaCl2溶液中 | |
| C. | 0.1mol•L-l稀H2SO4滴入0.1 mol•L-1Na2S2O3溶液中 | |
| D. | 0.2mol•L-1H2C2O4溶液滴入酸化的KMnO4溶液中 |
9. 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A. | 若a=1,则A为液体或固体 | |
| B. | 该反应正反应为放热反应 | |
| C. | T2>T1,p2>p1 | |
| D. | 其他条件不变,增加B的物质的量,化学平衡向正反应方向移动,化学平衡常数K增大 |
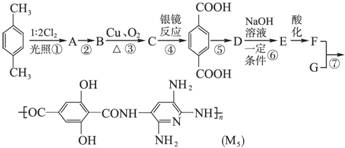
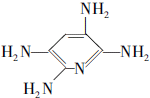 ,F的含氧官能团的名称有酯基和酚羟基.
,F的含氧官能团的名称有酯基和酚羟基.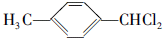 .
.