题目内容
10.根据元素周期律的知识,下列两者性质比较中,不正确的是( )| A. | 热稳定性:PH3<NH3 | B. | 金属性强弱:Na>Mg>Al | ||
| C. | 酸性强弱:HF>HCl>HBr>HI | D. | 原子半径:K>Si>Cl>F |
分析 A.非金属性越强,氢化物越稳定;
B.同周期元素从左到右金属性逐渐减弱;
C.同主族元素的非金属性越强,对应氢化物的酸性越弱;
D.同周期元素,随原子序数增大,原子半径减小;同主族自上而下原子半径增大.
解答 解:A.非金属性N>P,非金属性越强,氢化物越稳定,故A正确;
B.同周期元素从左到右金属性逐渐减弱,则金属性Na>Mg>Al,故B正确;
C.非金属性F>Cl>Br>I,同主族元素的非金属性越强,对应氢化物的酸性越弱,则酸性强弱:HI>HBr>HCl>HF,故C错误;
D.同周期元素,随原子序数增大,原子半径减小;同主族自上而下原子半径增大,则原子半径K>Si>Cl>F,故D正确.
故选C.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列各组物质中属于同系物的是( )
| A. | 金刚石和C60 | B. | 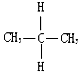 与 与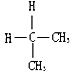 | ||
| C. | 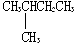 与 与 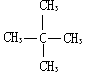 | D. | CH3CH3与CH3CH2CH2CH3 |
1. 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )| A. | 2H(g)→H2(g)△H>0 | B. | 图中E1=932kJ | ||
| C. | 图中E2=926 kJ | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
18. 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )| A. | 联氨的晶体是原子晶体 | |
| B. | 联氨易溶于水 | |
| C. | 1 mol联氨分子中含有5NA个σ键和NA个π键 | |
| D. | 联氨分子是非极性分子 |
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |
3.下列装置能将化学能转化为电能的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | HF>HCl>HBr>HI |
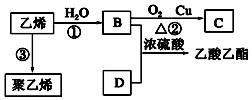 已知乙烯能发生以下转化:
已知乙烯能发生以下转化: ,列举聚乙烯的一种用途制塑料.
,列举聚乙烯的一种用途制塑料.
 .
.