题目内容
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |
分析 A、甲烷所处的状态不明确;
B、溶液体积不明确;
C、氯气和铁反应后变为-1价;
D、标况下苯为液体.
解答 解:A、甲烷所处的状态不明确,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、溶液体积不明确,故溶液中钠离子的个数无法计算,故B错误;
C、氯气和铁反应后变为-1价,故1mol氯气反应后得到2NA个电子,故C正确;
D、标况下苯为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.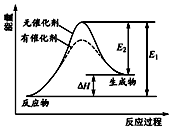 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 该反应的△H=E2-E1 | |
| D. | 该图可以表示燃料燃烧反应的能量变化 |
10.根据元素周期律的知识,下列两者性质比较中,不正确的是( )
| A. | 热稳定性:PH3<NH3 | B. | 金属性强弱:Na>Mg>Al | ||
| C. | 酸性强弱:HF>HCl>HBr>HI | D. | 原子半径:K>Si>Cl>F |
1.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2+I2?2HI) | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 滴加酚酞的氨水中加入氯化铵固体后红色变浅 |
11.根据下列实验操作和现象所得结论不正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1Na2CO3溶液的pH约为11;0.1mol•L-1NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗的干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
18.某元素最高价含氧酸的化学式是H2RO4,则该元素的气态氢化物化学式可表示为( )
| A. | HR | B. | H2R | C. | RH4 | D. | 不确定 |
15.下列除杂试剂或方法不恰当的是( )
| A. | 除去甲烷中的少量乙烯--通过酸性高锰酸钾溶液,洗气 | |
| B. | 除去乙酸乙酯中少量的乙酸--加入饱和碳酸钠溶液,分液 | |
| C. | 除去乙醇中少量的水--加足量生石灰,蒸馏 | |
| D. | 除去溴苯中溶有的溴--加氢氧化钠溶液,分液 |
16.对于反应H2(g)+I2(g)?2HI(g),能量变化如图所示,下列说法不正确的是( )

| A. | 该反应是放热反应 | B. | 升高温度平衡向逆反应方向移动 | ||
| C. | 增大压强,平衡不发生移动 | D. | 升高温度,反应的平衡常数K增大 |