题目内容
13.某元素在化学反应中由化合态变成游离态,则下列说法正确的是( )| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
分析 某元素在化学反应中由游离态变为化合态,元素的化合价可能升高,也可能降低.
解答 解:A.也可能被还原,如Fe+Cu2+=Fe2++Cu,故A错误;
B.可能被氧化,如Cl2+S2-=2Cl-+S,故B错误;
C.某元素在化学反应中由游离态变为化合态,如发生Fe+Cu2+=Fe2++Cu,则被还原,如发生Cl2+S2-=2Cl-+S,则被氧化,故C正确;
D.生成的单质可能是氧化产物,如Cl2+S2-=2Cl-+S中S是氧化产物,故D错误.
故选C.
点评 本题考查氧化还原反应,题目难度不大,本题注意结合中学化学所学到的知识,能举出一些实例即可解答.

练习册系列答案
相关题目
3.铁矿石(主要成份FeS)与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量之比为( )
| A. | 16:25 | B. | 1:7 | C. | 1:6 | D. | 2:11 |
1.已知NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
8.下列说法正确的是 ( )
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质不一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 在化学反应中,反应前后原子种类、数目和质量一定不变 |
5.有盐酸和醋酸两种溶液,c(Cl-)═c(CH3COO-),下列叙述正确的是( )
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
2.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如图:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
下列说法正确的是( )

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
| A. | 分离出甲醇的操作是结晶 | |
| B. | 间苯三酚与苯酚互为同系物 | |
| C. | 上述合成反应属于取代反应 | |
| D. | 洗涤时可以用饱和Na2CO3溶液除氯化氢 |
1.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如图一.
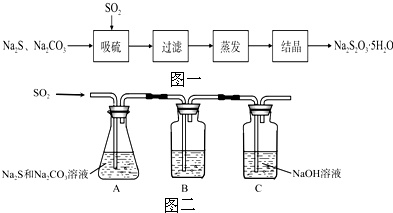
(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积或控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液,第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL.则c(Na2S2O3)=$\frac{6000a}{214V}$mol•L-1.(只列出算式,不作运算)
已知:IO3-+5I-+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏高(填“无影响”、“偏低”或“偏高”),原因是4I-+4H++O2═2I2+2H2O.

(1)吸硫装置如图二所示.
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积或控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上 层清液pH>10.2 | 样品含NaOH |
已知:IO3-+5I-+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能偏高(填“无影响”、“偏低”或“偏高”),原因是4I-+4H++O2═2I2+2H2O.