题目内容
10.下列关于有机化合物说法正确的是( )| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
分析 A.C3H6Cl2可以看作C3H8分子中2个H原子被2个Cl取代产物,2个Cl原子可以取代同一C原子上的两个氢原子,也可以取代不同C原子上的H原子,据此根据有机物烷烃的同分异构体的写法来书写其所有的同分异构体;
B.1,4-二甲基苯,甲基为对位;
C.乙烯使溴水和高锰酸钾溶液褪色,分别发生加成、氧化反应;
D.石油的分馏与沸点有关,煤的干馏生成煤焦油等.
解答 解:A.分子式为C3H6Cl2的有机物可以看作C3H8中的两个氢原子被两个氯原子取代,碳链上的3个碳中,两个氯原子取代一个碳上的氢原子,有2种:CH3-CH2-CHCl2 (甲基上的氢原子时一样)、CH3-CCl2 -CH3,分别取代两个碳上的氢,有2种:CH2Cl-CH2-CH2Cl(两个边上的),CH2Cl-CHCl-CH3 (一中间一边上),共有4种,故A正确;
B.1,4-二甲基苯,甲基为对位,也称为对二甲苯,故B错误;
C.乙烯使溴水和高锰酸钾溶液褪色,分别发生加成、氧化反应,原理不同,故C错误;
D.石油的分馏与沸点有关,煤的干馏生成煤焦油等,煤的干馏为化学变化,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.下列有关溶液中的离子平衡的有关叙述中,正确的是( )
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
1.已知NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
5.有盐酸和醋酸两种溶液,c(Cl-)═c(CH3COO-),下列叙述正确的是( )
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
15.将CH4、CO2催化重整为可用的化学品,对缓解能源危机、改善环境意义重大.
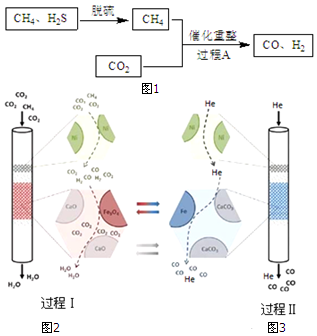
(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
运用有关化学原理解释实验结果:过程Ⅰ中存在平衡4CO+Fe3O4?3Fe+4CO2,添加的CaO与CO2结合成CaCO3,降低了c(CO2),使平衡正向移动,所以有Fe生成,使Fe3O4催化作用更好.

(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
2.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如图:

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
下列说法正确的是( )

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物.甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
| 物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
| 甲醇 | 64.7 | -97.8 | 易溶于水 |
| 3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
| A. | 分离出甲醇的操作是结晶 | |
| B. | 间苯三酚与苯酚互为同系物 | |
| C. | 上述合成反应属于取代反应 | |
| D. | 洗涤时可以用饱和Na2CO3溶液除氯化氢 |
19.有关如下反应的叙述正确的是( )
Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
Ⅰ:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ/mol
Ⅳ:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=akJ/mol.
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |