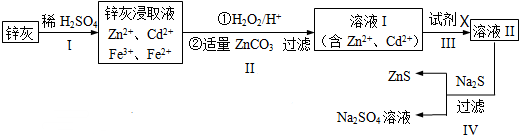
题目内容
17.下列说法正确的是( )| A. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| B. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| C. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
分析 A.合成氨反应为放热反应,升高温度后平衡向着逆向移动;
B.根据反应自发进行的判断依据△H-T△S<0分析解答;
C.向氨水中不断通入CO2,一水合氨浓度减小,铵根离子浓度增大,结合电离常数分析;
D.电镀池中,作阳极的是镀层金属,做阴极的是待镀金属.
解答 解:A.合成氨反应为放热反应,升高温度反应速率加快,平衡逆向移动,所以氢气的转化率减小,故A错误;
B.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,已知△S>0,由△H-T△S<0可知,说明该反应的△H>0,故B正确;
C.向氨水中不断通入CO2,一水合氨浓度减小,铵根离子浓度增大,由于$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}{•H}_{2}O)}$是常数,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小,故C错误;
D.在铁件的表面镀铜的电镀池中,作阳极的是镀层金属铜,与电源的正极相连,阳极上金属铜失电子发生氧化反应,阴极上铜离子得电子生成铜单质,铁与电源的负极相连做阴极,故D错误;
故选B.
点评 本题考查较为综合,涉及电镀原理的应用、弱电解质的电离、反应自发进行的判断以及化学平衡的影响因素等知识点,题目难度中等,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.(Ⅰ)氨基甲酸铵(NH2COONH4)的制备氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4.可用做肥料.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.
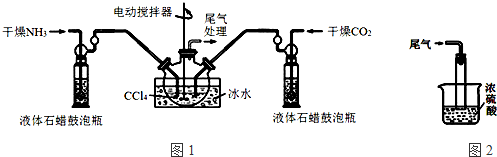
注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,制备绿矾(FeSO4•7H2O),补充完整由硫铁矿烧渣制备FeSO4•7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液中加入足量的铁粉,
③过滤,滤液中滴加NaOH溶液调节反应液的pH约为5,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是C(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液中加入足量的铁粉,
③过滤,滤液中滴加NaOH溶液调节反应液的pH约为5,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
8.异胡薄荷醉(结构如图所示)是合成青蒿素的原料之一,下列说法正确的是( )
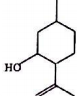

| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |
5.草药莪术根茎中含有一种色素,它的结构简式为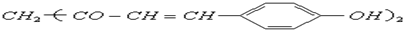 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
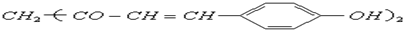 ,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )
,用它制成的试纸可以检验溶液的酸碱性.能够跟1mol该化合物起反应的Br2水溶液或H2的最大用量分别是( )| A. | 3mol 3mol | B. | 3mol 5mol | C. | 6 mol 10 mol | D. | 6 mol 8 mol |
2.下列有机物中,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
| A. | 1-溴丁烷 | B. | 2-甲基-3-氯戊烷 | ||
| C. | 2,2-二甲基-1-氯丁烷 | D. | 一氯甲烷 |
9.关于离子键、共价键的各种叙述中,下列说法中正确的是( )
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 任何物质里都含有化学键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
13.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是第四周期第Ⅷ族.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
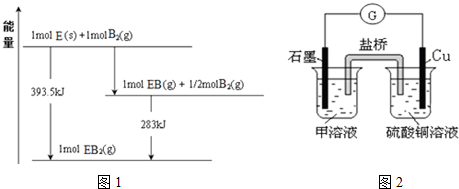
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.