题目内容
7.下列反应原理不符合工业冶炼金属实际情况的是( )| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ |
分析 金属的性质不同,活泼性不同,冶炼的方法不同,根据金属活动性强弱,可采用热还原法、电解法、热分解法等冶炼方法.
解答 解:A.Hg为不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,故A正确;
B.Fe处于金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,故B正确;
C.镁是活泼金属,应采用电解法氯化镁的方法制取,氧化镁的熔点太高,消耗太多的能量,故C错误;
D.Al是活泼金属,应采用电解法制取,故D正确.
故选C.
点评 本题考查金属冶炼的一般方法和原理,注意活泼性不同的金属冶炼的方法不同,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
17.下列各项实验操作中,正确的是( )
| A. | 用氨水洗涤试管内壁上的“银镜” | |
| B. | 只用溴水鉴别苯、CCH4、KI溶液、Na2SO4溶液 | |
| C. | 为加快过滤速度,用玻璃棒搅拌过滤器中的食盐水 | |
| D. | 为迅速除去乙酸乙酯中的少量乙酸,加入足量NaOH溶液并加热 |
18.下列关于氯水的说法中,不正确的是( )
| A. | 氯水是指氯气的水溶液 | |
| B. | 在pH试纸上滴新制氯水,试纸会先变红后褪色 | |
| C. | 久置的氯水漂白作用更强 | |
| D. | 新制氯水应避光保存 |
12.下列物质不是常见的室内污染物是( )
| A. | 甲苯 | B. | 甲醛 | C. | NO2 | D. | 氡 |
19.当温度不变时,恒容的容器中进行反应2A?B,若反应物的浓度由0.1mol•L-1降到0.06mol•L-1需20秒,那么由0.06mol•L-1降到0.036mol•L-1,所需反应的时间为( )
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
16.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 铁表而镀铜可以增强其抗腐蚀性 | |
| B. | 用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+$\frac{y}{4}$)O2$→_{高温}^{催化剂}$xCO2+$\frac{y}{2}$H2O | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 废旧电池中含有的重金属离子对水和土壤会造成污染,因而不能随意丢弃 |
17.某链状有机物分子中含有m个-CH3,n个-CH2,a个-CH-,其余为-NH2,则-NH2的数目可能是( )
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
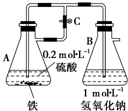 当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
当容器A中的反应开始后,若分别进行下列操作,请回答有关问题: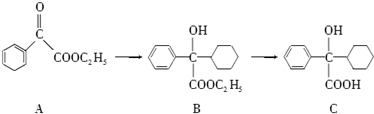
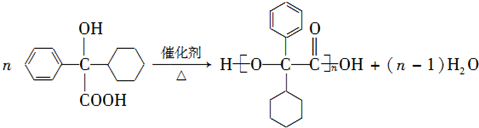 .
.