题目内容
下列离子方程式正确的是( )
| A、铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+ |
| C、石灰水与碳酸钠溶液混合:Ca2++CO32-=CaCO3↓ |
| D、硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
考点:离子方程式的书写
专题:
分析:A.稀盐酸具有弱氧化性,能将Fe氧化为亚铁离子而不是铁离子;
B.电荷不守恒;
C.二者反应生成碳酸钙和NaOH;
D.二者反应生成硫酸钡、硫酸钠和水,且按照物质的量2:1反应.
B.电荷不守恒;
C.二者反应生成碳酸钙和NaOH;
D.二者反应生成硫酸钡、硫酸钠和水,且按照物质的量2:1反应.
解答:
解:A.稀盐酸具有弱氧化性,能将Fe氧化为亚铁离子而不是铁离子,离子方程式为Fe+2H+=Fe2++H2↑,故A错误;
B.电荷不守恒,离子方程式为2Fe3++Cu=2Fe2++Cu2+,故B错误;
C.二者反应生成碳酸钙和NaOH,离子方程式为Ca2++CO32-=CaCO3↓,故C正确;
D.二者反应生成硫酸钡、硫酸钠和水,按照物质的量2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选CD.
B.电荷不守恒,离子方程式为2Fe3++Cu=2Fe2++Cu2+,故B错误;
C.二者反应生成碳酸钙和NaOH,离子方程式为Ca2++CO32-=CaCO3↓,故C正确;
D.二者反应生成硫酸钡、硫酸钠和水,按照物质的量2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选CD.
点评:本题考查离子方程式正误判断,明确离子性质及离子反应条件是解本题关键,注意要遵循客观事实、原子守恒、转移电子守恒及电荷守恒,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
A(g)+B(g)?C(g)+D(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1mol D,在Ⅲ中充入2molA和2molB,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D、容器Ⅰ中A的转化率与容器Ⅲ中A的转化率相同 |
下列说法正确的是( )
| A、可逆反应在其他条件不变时,升高温度,可以减小反应的活化能,加快反应速率 |
| B、S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表一个电子 |
| C、氮原子的第一电离能低于氧原子的第一电离能,因为氮比氧非金属性弱 |
| D、Fe3+ 比Fe2+稳定,因为Fe3+价电子构型是3d5,d亚层处于半充满状态,稳定 |
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
| C、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |

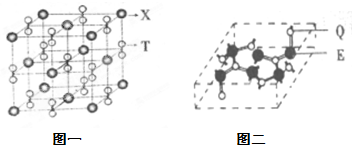 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28. 烯烃A在一定条件下可以按如图进行反应.
烯烃A在一定条件下可以按如图进行反应.