题目内容
Fe 2(SO4)3中的氧元素质量分数为2a%,则铁元素的质量分数为( )
| A、1-a% |
| B、1-2 a% |
| C、1-3 a% |
| D、3 a% |
考点:元素质量分数的计算
专题:
分析:Fe 2(SO4)3中S元素与氧元素质量之比为32:64=1:2,结合氧元素质量分数计算S元素质量分数,进而计算铁元素的质量分数.
解答:
解:Fe 2(SO4)3中S元素与氧元素质量之比为32:64=1:2,氧元素质量分数为2a%,则硫元素质量分数为2a%×
=a%,故铁元素的质量分数为1-a%-2a%=1-3a%,故选C.
| 1 |
| 2 |
点评:本题考查化学式有关计算、质量分数计算,比较基础,注意对化学式意义的理解掌握.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
在O.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH≒CH3COO-+H+对于该平衡,下列叙述正确的是
( )
( )
| A、加入少量CH3COONa固体,平衡向正反应方向移动 |
| B、加水,反应速率变小,平衡向正反应方向移动 |
| C、滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 |
| D、加入少量NaOH固体,平衡向逆反应方向移动 |
在含有NaI、Na2SO3和FeBr2 各1mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是( )
| A、NaCl、FeCl3、Na2SO4 |
| B、NaCl、FeBr3 |
| C、NaCl、Fe2O3、Na2SO4 |
| D、Na2SO4 |
下列离子方程式书写正确的是( )
| A、Na与H2O反应:Na+H2O=Na++OH-+H2↑ | ||
| B、NH4HCO3溶液与少量NaOH溶液混合:HCO3-+OH-=CO32-+H2O | ||
| C、用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | ||
D、溴代乙酸与足量氢氧化钠溶液反应:CH2BrCOOH+NaOH
|
在298K时,NaCl 在水中的溶解度为
水.如将1molNaCl溶解在1L水中,此溶解过程中体系的△H-T△S和熵如何变化( )
| 26g |
| 100g |
| A、△H-T△S<0△S<0 |
| B、△H-T△S<0△S>0 |
| C、△H-T△S>0△S>0 |
| D、△H-T△S>0△S<0 |
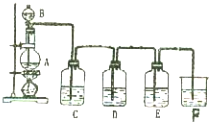 实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:
实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题: