题目内容
比较Cl、Cl-、S2-半径大小 .
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:
分析:电子层结构相同,核电荷数越大离子半径越小,阴离子半径小于相应的原子半径.
解答:
解:Cl-、S2-电子层结构相同,核电荷数越大离子半径越小,故离子半径:Cl-<S2-,阴离子半径小于相应的原子半径,则半径为Cl<Cl-,故微粒半径:Cl<Cl-<S2-,故答案为:Cl<Cl-<S2-.
点评:本题考查微粒半径比较,难度不大,注意理解掌握微粒半径比较规律.

练习册系列答案
相关题目
有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A、肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ |
| B、肯定有Al3+、K+、Cl-,肯定没有MnO4- |
| C、肯定有Al3+、Cl-,一定没有HCO3-和SO42- |
| D、该溶液可能显弱酸性,也可能显中性 |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4 第一电离能最大是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
Fe 2(SO4)3中的氧元素质量分数为2a%,则铁元素的质量分数为( )
| A、1-a% |
| B、1-2 a% |
| C、1-3 a% |
| D、3 a% |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g?cm-3,浓度为amol?L-1,另一份质量分数为W2,密度为 ρ2g?cm-3,浓度为b mol?L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是( )
| A、ρ1=ρ2 |
| B、ρ1<ρ2 |
| C、ρ1>ρ2 |
| D、无法比较 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、25°C时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、一定条件下1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
关于氢键,下列说法正确的是( )
| A、含氢元素的化合物中一定有氢键 |
B、因为分子间存在氢键的缘故,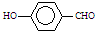 比 比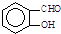 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、“可燃冰”--甲烷水合物(例如:8CH4?46H2O)中CH4与H2O之间存在氢键 |