题目内容
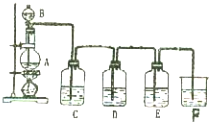 实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:
实验室用图所示装置制备氯气,并进行氯气性质实验,请回答下列问题:(1)A中加入二氧化锰,B中盛有浓盐酸,则烧瓶中发生反应的离子方程式为
(2)C中盛有紫色石蕊溶液,则C中的现象是
(3)E中是AgNO3溶液,现象是
(4)F中一般应盛有
考点:氯气的实验室制法
专题:实验题
分析:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,氯气与水反应生成氯化氢和次氯酸,氯化氢为强电解质电离产生氢离子和氯离子,次氯酸具有强的氧化性,具有漂白性,氯气能够与氢氧化钠发生反应,通常用氢氧化钠溶液吸收过量的氯气进行尾气处理,据此解答.
解答:
解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)氯水中含有氢离子溶液显酸性,能够使石蕊 显红色,又含有次氯酸具有偏白性,能够使红色溶液褪色,
故答案为:先变红后褪色;
(3)氯气溶于水与水反应生成氯化氢和次氯酸,氯化氢电离产生氯离子,氯离子能够与银离子反应生成白色的氯化银沉淀,化学方程式为:Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
故答案为:产生白色沉淀;Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
(4)氯气有毒,直接排放到空气中能污染空气,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,可以用来吸收氯气;
故答案为:氢氧化钠;吸收过量的氯气.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)氯水中含有氢离子溶液显酸性,能够使石蕊 显红色,又含有次氯酸具有偏白性,能够使红色溶液褪色,
故答案为:先变红后褪色;
(3)氯气溶于水与水反应生成氯化氢和次氯酸,氯化氢电离产生氯离子,氯离子能够与银离子反应生成白色的氯化银沉淀,化学方程式为:Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
故答案为:产生白色沉淀;Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
(4)氯气有毒,直接排放到空气中能污染空气,氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,可以用来吸收氯气;
故答案为:氢氧化钠;吸收过量的氯气.
点评:本题考查了氯水的性质,明确氯气与水反应的实质、掌握氯水中的成分是解题关键,侧重考查学生对基础知识的掌握,题难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、碱性溶液中:ClO-、Cl-、K+、Na+ |
| B、常温常压下气体:O2、N2、Cl2、NH3 |
| C、含有AlO2-的溶液:NO3-、HCO3-、Na+、K+ |
| D、氢氧化铁胶体:H+、K+、S2-、Br- |
某无色透明溶液中,下列离子能够大量共存的是( )
| A、H+、NH4+、AlO2-、S2O32- |
| B、K+、Cu2+、OH-、Cr2O72- |
| C、Na+、Al3+、SO42-、NO3- |
| D、Ag+、Mg2+、CO32-、I- |
 用如图装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑
用如图装置做喷泉实验,该实验条件下的气体摩尔体积为a L/mol,且不考虑2NO2?N2O4.最终液体充满了烧瓶,则烧瓶内溶液的物质的量浓度约是( )
A、
| ||
B、
| ||
C、
| ||
| D、无法计算 |
有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A、肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ |
| B、肯定有Al3+、K+、Cl-,肯定没有MnO4- |
| C、肯定有Al3+、Cl-,一定没有HCO3-和SO42- |
| D、该溶液可能显弱酸性,也可能显中性 |
25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
| A、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)>c(OH-)+c(CH3COO-) |
| B、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| D、pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2 NaCN+HF═HCN+NaF NaNO2+HF═HNO2+NaF.由此可判断下列叙述中不正确的是( )
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN |
| D、K(HCN)<K(HNO2)<K(HF) |
Fe 2(SO4)3中的氧元素质量分数为2a%,则铁元素的质量分数为( )
| A、1-a% |
| B、1-2 a% |
| C、1-3 a% |
| D、3 a% |