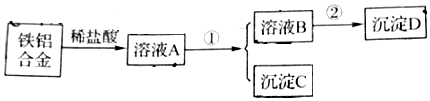
题目内容
13.下列关于有机物因果关系的叙述中,完全正确的一组是( )| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯分子和乙烯分子含有相同的碳碳双键 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯在一定条件下都能与水反应 | 二者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯使溴水褪色是苯萃取溴水的溴;
B.乙酸含有羧基显酸性,能与NaHCO3溶液反应;
C.淀粉和纤维素都是高分子化合物,分子式不同;
D.乙酸乙酯与水的反应水解反应,乙烯与水的反应属于加成反应.
解答 解:A.乙烯含有C=C双键,与溴发生加成反应,使溴水褪色,苯使溴水褪色是苯萃取溴水的溴,苯分子中不含碳碳双键,故A错误;
B.乙酸含有羧基显酸性,乙酸的酸性大于碳酸,所以乙酸能与NaHCO3溶液反应生成二氧化碳,故B正确;
C.淀粉和纤维素都是高分子化合物,分子式不同,不是同分异构体,故C错误;
D.乙酸乙酯与水的反应水解反应,乙烯与水的反应属于加成反应,反应类型不同,故D错误;
故选B.
点评 本题考查苯、乙烯、乙酸、酯、葡萄糖的性质等,比较基础,注意A选项中苯使溴水褪色原理是发生了萃取是物理变化,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
1.从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液.现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
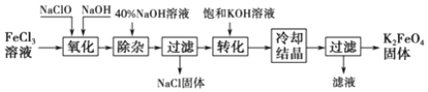
已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
已知溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全.
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.
8.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
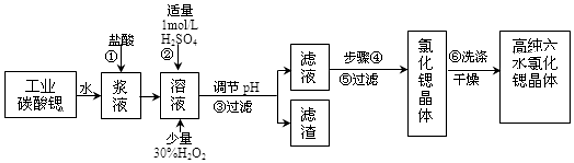
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.
5.下列说法正确的是( )
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
2.容器体积不变时,对于合成氨的反应,下列状态达平衡的是( )
| A. | 氮气和氢气不再发生反应时的状态 | |
| B. | 体系中的总压强不变时的状态 | |
| C. | 氮气的浓度与氢气的浓度之比为1:3时 | |
| D. | 混合物的密度保持不变时的状态 |
3.下列操作中不正确的是( )
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸处 |