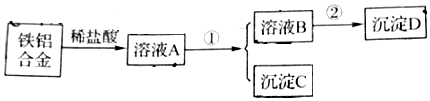
题目内容
12.下列实验操作或说法正确的是( )
| A. | 用玻璃棒蘸取CH3COOH溶液点在用水湿润的pH试纸上,测定该溶液的pH | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| D. | 用如图装置乙加热分解NaHCO3固体 |
分析 A.pH试纸不能湿润;
B.加沸石,以防暴沸,且液体温度过高时加沸石,液体易飞溅;
C.分液时避免上下层液体混合;
D.碳酸氢钠加热分解有水生成.
解答 解:A.pH试纸不能湿润,则用玻璃棒蘸取CH3COOH溶液点在干燥的pH试纸上,测定该溶液的pH,故A错误;
B.加沸石,以防暴沸,且液体温度过高时加沸石,液体易飞溅,则在沸腾前忘记加沸石,应立即停止加热,冷却后补加,故B正确;
C.分液时避免上下层液体混合,则放出水相后,从分液漏斗的上口倒出有机相,故C错误;
D.碳酸氢钠加热分解有水生成,则试管口应略向下倾斜,故D错误;故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握pH的测定、混合物分离提纯、性质实验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
15.下列变化不能用勒夏特列原理解释的是( )
| A. | 氯水宜保存在低温、避光条件下 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 打开汽水瓶,看到有大量的气泡逸出 |
13.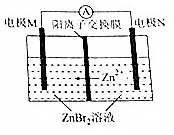 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )| A. | 放电时,电极N为正极 | |
| B. | 放电时.正极的电极反应式为Br2+2e-═2B- | |
| C. | 充电时,电极M与直流电源的负极相连 | |
| D. | 充电时,Zn2+通过离子交换膜从右向左迁移 |
7.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
17.下列叙述正确的是( )
| A. | 6.02×1023叫做阿伏加德罗常数 | |
| B. | 摩尔(mol)是国际单位制中七个基本单位之一 | |
| C. | 1mol气体的体积随压强和温度的增大而变小 | |
| D. | 气体摩尔体积(Vm)是指1 mol任何气体所占的体积都约为22.4 L |
1.从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液.现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
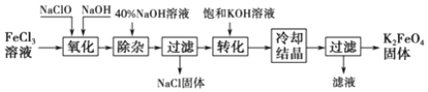
已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
已知溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全.
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水.在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.高锰酸钾具有强氧化性.高锰酸钾(K2FeO4)与水作用产生Fe(OH)3.
(1)检验废液中含有Fe2+选用的试剂是KMnO4(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是Cl2(填化学式),加入时发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是杀菌消毒和净水.
(3)“氧化”过程反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和漏斗,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用饱和KOH溶液溶解,然后加热浓缩、冷却结晶、过滤.
(5)用回收的铜为原料可制得粗制CuSO4•5H2O晶体(含有少量的FeSO4•7H2O),除去CuSO4•5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4•5H2O的晶体.
已知:室温时一些物质的Kaq如表:
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
加双氧水的目的是将亚铁离子氧化成铁离子;若溶液中CuSO4的浓度为3.0mol•L-1,通过计算说明此方法可除去粗制CuSO4•5H2O晶体中FeSO4•7H2O的理由通常认为溶液中的离子浓度小于1×10-6mol•L-1时就认定沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,则Cu(OH)2开始沉淀时的PH为4,Fe3+完全沉淀时溶液的PH为3.3,通过计算确定上述方案可行.
2.容器体积不变时,对于合成氨的反应,下列状态达平衡的是( )
| A. | 氮气和氢气不再发生反应时的状态 | |
| B. | 体系中的总压强不变时的状态 | |
| C. | 氮气的浓度与氢气的浓度之比为1:3时 | |
| D. | 混合物的密度保持不变时的状态 |