题目内容
16.以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
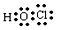 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
分析 均为短周期元素,M为非金属元素,其气态氢化物的水溶液呈碱性,则M为N元素;A的单质与冷水剧烈反应,得到强碱性溶液,可知A为Na;B的原子最外层电子数是内层电子数的三倍,B为O;在第三周期中,C的简单离子半径最小,C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl;所有有机物中都含有E元素,则E为C,以此来解答.
解答 解:由上述分析可知,M为N,A为Na,B为O,C为Al,D为Cl,E为C,
(1)B在周期表中的位置为第二周期第VIA族,C离子的结构示意图为 ,故答案为:第二周期第VIA族;
,故答案为:第二周期第VIA族; ;
;
(2)D的最低价含氧酸为HClO,其电子式为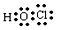 ,故答案为:
,故答案为: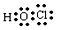 ;
;
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),负极上氨气失去电子,则负极反应方程式为2NH3-6e-+6OH-═N2+6H2O,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,该物质为C,由质量守恒定律可知反应为4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C,故答案为:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)由A、B、E组成的一种生活中的常用盐为碳酸钠或碳酸氢钠,碳酸氢钠中A的质量分数为27%,由A的质量分数为43%,可知该盐为碳酸钠,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-,故答案为:CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素化合物知识等来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.(1)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
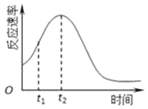
(2)双鸭山市第一中学高二化学兴趣小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①此反应放热,温度升高,化学反应速率加快;②生成物中的锰离子(或硫酸锰)为此反应的催化剂.
(3)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=3,C=100,E=20
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 40 | 100 | 60 | t1 |
| ② | 常温 | A | B | C | 60 | t2 |
| ③ | 常温 | 3 | 80 | D | E | t3 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
| 操作 | 现象 | 结论 | |
| A | 将含酚酞的Na2CO3溶液与BaCl2溶液混合 | 红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 将Cl2通入I2淀粉溶液中 | 溶液蓝色褪去 | Cl2有漂白性 |
| C | 向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 试管中加入少量淀粉和稀硫酸,冷却后加入NaOH溶液中和至碱性,再加入碘水 | 溶液未变蓝 | 淀粉己完全水解 |
| A. | A | B. | B | C. | C | D. | D |
 NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中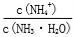 先增大再减小
先增大再减小