题目内容
6.下列实验操作对应的现象、结论均正确的是( )| 操作 | 现象 | 结论 | |
| A | 将含酚酞的Na2CO3溶液与BaCl2溶液混合 | 红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 将Cl2通入I2淀粉溶液中 | 溶液蓝色褪去 | Cl2有漂白性 |
| C | 向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 试管中加入少量淀粉和稀硫酸,冷却后加入NaOH溶液中和至碱性,再加入碘水 | 溶液未变蓝 | 淀粉己完全水解 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-,加入BaCl2溶液会生成BaCO3沉淀;
B.Cl2能把I2氧化为HIO3;
C.相同条件下,溶度积小的先生成沉淀;
D.NaOH溶液与碘水反应生成NaI和NaIO3.
解答 解:A.Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-,加入BaCl2溶液会生成BaCO3沉淀,CO32-的浓度减小,水解平衡向逆方向移动,溶液碱性减弱,所以溶液红色变浅,故A正确;
B.将Cl2通入I2淀粉溶液中,Cl2能把I2氧化为HIO3,所以溶液的蓝色会褪去,没有表现Cl2的漂白性,故B错误;
C.向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液,出现黄色沉淀,说明AgI先沉淀,所以AgI的溶度积小,即Ksp(AgCl)>Ksp(AgI),故C正确;
D.NaOH溶液与碘水反应生成NaI和NaIO3,淀粉遇到碘的化合物不变蓝色,所以不能判断溶液中是否含有淀粉,故D错误.
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,把握盐的水解平衡移动、物质的性质、物质的检验、沉淀的转化为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
16.以下元素均为短周期元素:
(1)B在周期表中的位置第二周期第VIA族,C离子的结构示意图 .
.
(2)D的最低价含氧酸的电子式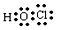 .
.
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
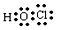 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
17.下列各项表述正确的是( )
| A. | 丙烯的键线式: | B. | CH2F2的电子式: | ||
| C. | 醛基官能团符号:-COH | D. | -OH与 都表示羟基 都表示羟基 |
14.T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
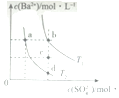

| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
1.阿司匹林(乙酰水杨酸,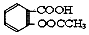 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
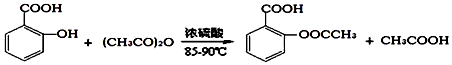
操作流程如图:
主要试剂和产品的物理常数:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐易水解.
(2)合成过程中最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流的装置如图所示:
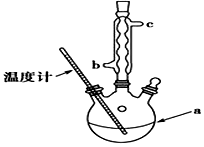
①a仪器的名称三颈烧瓶,冷凝水的流出方向是c(填“b”或“c”).
②趁热过滤的原因是防止乙酰水杨酸结晶析出.
③检验最终产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸.
④下列说法正确的是ab.
a.此种提纯方法中乙酸乙酯的作用是作溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大.
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称量产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%.(用百分数表示,保留至小数点后一位)
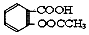 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
操作流程如图:
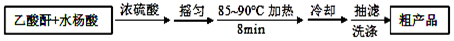
主要试剂和产品的物理常数:
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐易水解.
(2)合成过程中最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流的装置如图所示:

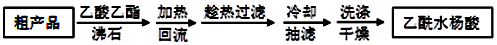
①a仪器的名称三颈烧瓶,冷凝水的流出方向是c(填“b”或“c”).
②趁热过滤的原因是防止乙酰水杨酸结晶析出.
③检验最终产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸.
④下列说法正确的是ab.
a.此种提纯方法中乙酸乙酯的作用是作溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大.
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称量产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%.(用百分数表示,保留至小数点后一位)
11.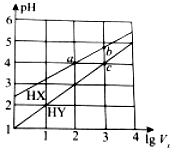 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
18.下列有关有机物的结构和性质的说法中,正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 苯和浓硝酸的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 可以用新制的氢氧化铜悬浊液检验尿液中是否含有葡萄糖 |
15.天然气经O2和H2O(g)重整制合成气,再由合成气制备甲醇的相关反应如下
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
16.下列说法正确的是( )
| A. | 常温常压下,氯气的摩尔质量等于71g | |
| B. | 1molH2SO4中含有2mol氢元素 | |
| C. | 某物质的摩尔质量就是该物质的相对分子质量或相对原子质量 | |
| D. | 2g氦气所含的原子数目约为0.5×6.02×1023 |