题目内容
13.通过初中和高中有机化合物的学习,你认为下列有关有机化合物的说法中正确的是( )| A. | 凡是含有碳元素的化合物都是有机化合物 | |
| B. | 所有的有机化合物均难溶解于水 | |
| C. | 有机物组成元素较少,而有机物的种类繁多 | |
| D. | 完全燃烧只生成CO2和H2O的有机物是烃 |
分析 A.根据有机物的定义分析;
B.有的有机化合物易溶于水;
C.有机物的组成元素一定含碳,还可能含O、H、N、S、P等;
D.烃的含氧衍生物燃烧也生成二氧化碳和水.
解答 解:A.碳酸钙、二氧化碳含碳元素,但是无机物,故A错误;
B.有的有机化合物易溶于水,如乙醇,故B错误;
C.有机物的组成元素一定含碳,还可能含O、H、N、S、P等,元素种类比较少,但有机物中碳原子能与其他原子形成四个共价键(可以是双键,可以是单间,可以是叁键),且碳原子之间也能相互成键,可以成碳链,可以成碳环,此外含碳的有机物存在同分异构现象,故自然界中有机物种类繁多,故C正确;
D.烃的含氧衍生物燃烧也生成二氧化碳和水,故燃烧生成了二氧化碳和水的不一定是挺,故D错误.
故选C.
点评 解答本题要掌握有机物方面的知识,同时要理解CO、CO2及含CO32-的化合物,虽然它们是含有碳元素的化合物,但是化学性质和无机物相似,属于无机物.

练习册系列答案
相关题目
6.碳酸钙是一种用途非常广泛的产品,可用于生成硫酸、漂白粉等一系列物质(如图).下列说法正确的
是( )
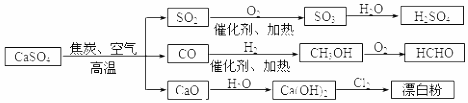
是( )

| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
1.对于amolH2O和amolCO2的说法正确的是( )
| A. | 相同条件下体积一定相同 | B. | 氧原子个数一定相同 | ||
| C. | 分子个数一定相同 | D. | 质量比是22:9 |
8.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )
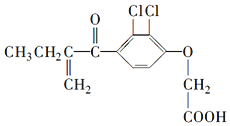

| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
18.为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验.
(1)实验Ⅰ的现象有白色沉淀产生,写出反应的离子方程式Ba++SO42+=BaSO4↓.
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
| 编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 实验 |  | 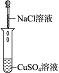 | 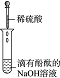 |  |
(2)实验Ⅱ的目的是验证Cl-与Cu2+不发生反应.
(3)实验Ⅲ的现象证明了溶液中的H+、OH-两种离子之间发生了化学反应.
(4)实验Ⅳ中发生反应的离子方程式是CaCO3+2H+═Ca2++CO2↑+H2O.
5.(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:
CH3OH (l)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O(l)△H=-726.5KJ/mol.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=a kJ•mol-1.有关键能数据如表:
试根据表中所列键能数据估算a的数值-93.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:
△H=+226.7 KJ/mol.
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示
意图如图:

第一步反应是放热反应(填“放热”或“吸热”),原因是反应物总能量高于生成物总能量.
CH3OH (l)+$\frac{3}{2}$ O2(g)=CO2(g)+2H2O(l)△H=-726.5KJ/mol.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)?2NH3(g)△H=a kJ•mol-1.有关键能数据如表:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:
△H=+226.7 KJ/mol.
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示
意图如图:

第一步反应是放热反应(填“放热”或“吸热”),原因是反应物总能量高于生成物总能量.
 W+3H2O
W+3H2O