题目内容
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1 L 1 mol?L-1的氯化铁溶液中铁离子的数目为NA |
| B、标准状况下,2.24L CH2Cl2含有的分子数为0.1NA |
| C、78g Na2O2固体与足量H2O反应转移的电子数为NA |
| D、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、Fe3+是弱碱阳离子,在水溶液中会水解;
B、标况下,CH2Cl2为液态;
C、Na2O2与H2O的反应为歧化反应;
D、考虑纯水永远呈中性,即C(H+)=C(OH-).
B、标况下,CH2Cl2为液态;
C、Na2O2与H2O的反应为歧化反应;
D、考虑纯水永远呈中性,即C(H+)=C(OH-).
解答:
解:A、Fe3+是弱碱阳离子,在水溶液中会水解,故铁离子的数目会小于NA,故A错误;
B、标况下,CH2Cl2为液态,故B错误;
C、78g Na2O2的物质的量n=
=
=1mol,Na2O2与H2O的反应为歧化反应:2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,故1molNa2O2转移1mol电子,即NA个,故C正确;
D、在温度不是25℃时,水的离子积不一定是10-14.pH=6的纯水中C(H+)=10-6mol/L,而纯水永远呈中性,即C(OH-)=C(H+)=10-6mol/L,故D错误.
故选C.
B、标况下,CH2Cl2为液态,故B错误;
C、78g Na2O2的物质的量n=
| m |
| M |
| 78g |
| 78g/mol |
D、在温度不是25℃时,水的离子积不一定是10-14.pH=6的纯水中C(H+)=10-6mol/L,而纯水永远呈中性,即C(OH-)=C(H+)=10-6mol/L,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的计算,关键是掌握公式的运用和物质的结构性质,难度不大.

练习册系列答案
相关题目
下列除杂方法正确的是( )
| A、用金属钠除去乙醇中混有的少量水 |
| B、用酸性KmnO4溶液除去甲烷中混有的少量乙烯 |
| C、用H2除去乙烷中混有的少量乙烯 |
| D、用饱和Na2CO3溶液除去乙酸乙酯中混有的少量乙醇和乙酸 |
在FeBr2和FeI2混合溶液中逐渐通氯气,可能发生的反应的离子方程式是( )
| A、2Fe2++Cl2→2Fe3++2Cl - |
| B、2Fe2++2Br -+2I -+3Cl2→2Fe3++I2+Br2+6Cl - |
| C、2Fe2++4Br -+2I -+4Cl2→2Fe3++I2+2Br2+8Cl - |
| D、4Fe2++2Br -+2I -+4Cl2→4Fe3++I2+Br2+8Cl - |
某无色溶液能使紫色石蕊试液变红色,经实验测得该溶液中存在Ba2+和NO3-,则该溶液中还可能大量存在的离子组是( )
| A、NH4+、Mg2+、Cl-、K+ |
| B、Fe2+、Na+、Cl-、I- |
| C、SO42-、HCO3-、Cl-、K+ |
| D、AlO2-、Na+、Cl-、OH- |
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划分为同一类物质.下列分类标准正确的是( )
①钠的化合物 ②能与硝酸反应的物质 ③电解质 ④钠盐 ⑤钠的含氧化合物.
①钠的化合物 ②能与硝酸反应的物质 ③电解质 ④钠盐 ⑤钠的含氧化合物.
| A、①④ | B、③④ | C、②⑤ | D、①③ |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、0.5mol O2所含氧元素数为NA |
| B、0.2mol H2O所含的H原子数为0.2NA |
| C、0.1mol CH4所含电子数为NA |
| D、46克NO2和N2O4的混合物含有的分子数为NA |
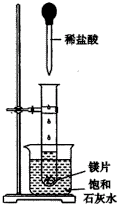 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答: 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.
将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol?L-1的NaOH溶液.当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2=650mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750mL时,沉淀量不再改变.