题目内容
在FeBr2和FeI2混合溶液中逐渐通氯气,可能发生的反应的离子方程式是( )
| A、2Fe2++Cl2→2Fe3++2Cl - |
| B、2Fe2++2Br -+2I -+3Cl2→2Fe3++I2+Br2+6Cl - |
| C、2Fe2++4Br -+2I -+4Cl2→2Fe3++I2+2Br2+8Cl - |
| D、4Fe2++2Br -+2I -+4Cl2→4Fe3++I2+Br2+8Cl - |
考点:离子方程式的书写
专题:离子反应专题
分析:Cl2既可氧化I-为I2,也可氧化Br-为Br2,也可氧化Fe2+为Fe3+,因还原性I->Fe2+>Br-,所以通入氯气,首先氧化I-,然后氧化Fe2+,最后氧化Br-,据此分析解答.
解答:
解:氧化还原反应中:氧化剂优先氧化还原性强的离子,再氧化还原性弱的离子,还原性I->Fe2+>Br-,则通入氯气后,氯气首先氧化I-,然后氧化Fe2+,最后氧化Br-,
A.因还原性I->Fe2+>Br-,通入氯气后,碘离子优先反应,亚铁离子若被氯气氧化,则碘离子一定反应完全,不可能只发生反应:Fe2++Cl2═Fe3++2Cl-,故A错误;
B.当n(FeBr2):n(FeI2):n(Cl2)=1:1:3时,I-、Fe2+、Br-全部被氧化,发生反应2Fe2++2Br-+2I-+3C12═2Fe3++I2+Br2+6Cl-,故B正确;
C.2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl-,该反应中,溴离子的计量数为4、碘离子的计量数为2,则被氧化的铁的计量数至少为:(
=3),即:当n(FeBr2):n(FeI2):n(Cl2)=2:1:4时,I-、Fe2+全部被氧化,Br-部分被氧化,发生反应为:6Fe2++6Br-+4I-+8Cl2═6Fe3++2I2+3Br2+16Cl-,故C错误;
D.当n(FeBr2):n(FeI2):n(Cl2)=3:1:4时,I-、Fe2+全部被氧化,Br-部分被氧化,发生 4Fe2++2Br-+2I-+4Cl2═4Fe3++I2+Br2+8Cl-,故D正确;
故选BD.
A.因还原性I->Fe2+>Br-,通入氯气后,碘离子优先反应,亚铁离子若被氯气氧化,则碘离子一定反应完全,不可能只发生反应:Fe2++Cl2═Fe3++2Cl-,故A错误;
B.当n(FeBr2):n(FeI2):n(Cl2)=1:1:3时,I-、Fe2+、Br-全部被氧化,发生反应2Fe2++2Br-+2I-+3C12═2Fe3++I2+Br2+6Cl-,故B正确;
C.2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl-,该反应中,溴离子的计量数为4、碘离子的计量数为2,则被氧化的铁的计量数至少为:(
| 4+2 |
| 2 |
D.当n(FeBr2):n(FeI2):n(Cl2)=3:1:4时,I-、Fe2+全部被氧化,Br-部分被氧化,发生 4Fe2++2Br-+2I-+4Cl2═4Fe3++I2+Br2+8Cl-,故D正确;
故选BD.
点评:本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
水是最宝贵的资源之一.下列表述正确的是( )
A、H2O的电子式为 |
| B、4℃时,纯水的pH=7 |
| C、D216O中,质量数之和是质子数之和的两倍 |
| D、水分子在三种状态中,分子间的平均距离d:d(气态)>d(液态)>d(固态) |
一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2总量的是( )
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
| A、①③④ | B、①③⑤ |
| C、②④⑥ | D、③④⑤ |
下列有关化学用语中不能体现氮原子核外电子能量有差异的是( )
A、 |
B、 |
C、 |
| D、1s22s22p3 |
用已知浓度的NaOH溶液滴定待测浓度的盐酸(盐酸置于锥形瓶中),以下操作会造成所测盐酸溶液浓度偏低的是( )
| A、酸式滴定管未用待装溶液润 |
| B、碱式滴定管未用待装溶液润洗 |
| C、滴定前平视滴定管刻度线,滴定终了仰视刻度线 |
| D、在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
下列说法正确的是( )
| A、蔗糖水解只生成葡萄糖 |
| B、含有碳碳双键的有机物均存在顺反异构现象 |
| C、向混有苯酚的苯中加入金属Na有无色气体生成 |
| D、用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基放电充电 |
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1 L 1 mol?L-1的氯化铁溶液中铁离子的数目为NA |
| B、标准状况下,2.24L CH2Cl2含有的分子数为0.1NA |
| C、78g Na2O2固体与足量H2O反应转移的电子数为NA |
| D、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
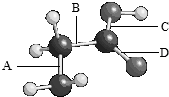 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.