题目内容
4.欲配制480mL0.5mol•L-1的NaOH溶液,试回答下列问题.(1)计算:需要NaOH固体的质量为10.0g.
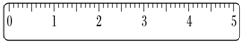
(2)假定最终称量小烧杯的质量为32.6g(填“32.6g”或“32.61g”).在标尺(图)上画出游码位置(画“△”表示).
(3)某学生实际配制的NaOH溶液的浓度为0.51mol•L-1,原因可能是DF.
A.使用滤纸称量NaOH固体
B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤
D.用胶头滴管加水定容时俯视刻度
E.加水时超过刻度线,用胶头滴管吸出
F.转移溶液时未经冷却
(4)假设该同学成功配制了0.400mol•L-1的盐酸,他又用该盐酸中和含100mL的NaOH溶液,则该同学需取125mL盐酸.
分析 (1)配制480mL0.5mol•L-1的NaOH溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量;
(2)托盘天平精确值为0.1g;小于5g用游码,据此解答;
(3)根据c=$\frac{n}{V}$判断配制溶液误差,如果n偏小或V偏大都导致c偏小,如果n偏大或V偏小都导致c偏大.
(4)根据n(HCl)=n(NaOH)计算.
解答 解:(1)配制480mL0.5mol•L-1的NaOH溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质氢氧化钠的质量m=0.5mol/L×40g/mol×0.5L=10.0g;
故答案为:10.0g;
(2)托盘天平的精确度是0.1g,所以称量药品质量为32.6g,砝码质量为30g,游码的质量是2.6g,其图为 ,
,
故答案为:32.6g; ;
;
(3)A.使用滤纸称量NaOH固体,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.容量瓶中原来存有少量水,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不变,故B不选;
C.溶解后的烧杯未经多次洗涤,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.用胶头滴管加水定容时俯视刻度,导致溶液体积偏小,溶液浓度偏高,故D选;
E.加水时超过刻度线,用胶头滴管吸出,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故E不选;
F.转移溶液时未经冷却,冷却后液面下降,溶液体积偏小,溶液浓度 偏高,故F选;
故选:DF;
(4)100mL0.5mol•L-1的NaOH溶液含有氢氧化钠物质的量为0.1L×0.5mol/L=0.05mol,需要0.400mol•L-1的盐酸物质的量为$\frac{0.05mol}{0.400mol/L}$=0.125L;即125mL;
故答案为:125.
点评 本题考查了物质的量浓度的有关计算及配制一定物质的量浓度的溶液等知识点,要注意配制一定物质的量浓度溶液的误差分析,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 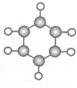 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$
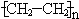 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
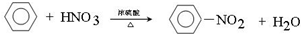
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
| A. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| B. | 钠与乙醇反应比与水反应要剧烈得多 | |
| C. | 除去苯中的苯酚可采用加入足量的NaOH溶液后分液的方法 | |
| D. | 除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化 |
| A. | Fe在一定条件下与水反应生成H2和Fe(OH)3 | |
| B. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不显血红色 | |
| C. | FeCl2溶液蒸干后得到的是Fe(OH)3固体 | |
| D. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 |
 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$ △H═88.6kJ•mol-1
△H═88.6kJ•mol-1