题目内容
甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应 I:CO(g)+2H2(g)═CH3OH(g)△H1
反应 II:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”的是 (填“I”或“II”)
②下表所列数据是反应 I 在不同温度下的化学平衡常数 K
由表中数据判断,△H1 0 (填“>”、“=”或“<”)
③某温度下,将2mol CO和6mol H2 充入2L的密闭容器中,充分反应,达到平衡后,测得C(CO)=0.2mol?L-1 则CO的转化率为 反应的平衡常数为
此时的温度为 (从上表中选择)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ?mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(1)工业上一般采用下列两种反应合成甲醇:
反应 I:CO(g)+2H2(g)═CH3OH(g)△H1
反应 II:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”的是
②下表所列数据是反应 I 在不同温度下的化学平衡常数 K
| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2 充入2L的密闭容器中,充分反应,达到平衡后,测得C(CO)=0.2mol?L-1 则CO的转化率为
此时的温度为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=-1275.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ?mol-1
③H2O(g)═H2O(l)△H3=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②反应物总能量大于生成物总能量时,该反应为放热反应;
③根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率;列式三段式计算平衡浓度,结合平衡常数概念计算得到,再根据表格分析;
(2)依据热化学方程式和盖斯定律计算得到.
②反应物总能量大于生成物总能量时,该反应为放热反应;
③根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率;列式三段式计算平衡浓度,结合平衡常数概念计算得到,再根据表格分析;
(2)依据热化学方程式和盖斯定律计算得到.
解答:
解:(1)①根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,故选Ⅰ;
②根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,则△H1<0,故答案为:<;
③平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
×100%=80%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
K=
=2.041,对照图表数据判断温度为250℃,
故答案为:80%;2.041;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
得到热化学方程式为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
②根据图象知,反应物总能量大于生成物总能量,所以该反应是放热反应,则△H1<0,故答案为:<;
③平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
| (2-0.4)mol |
| 2mol |
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
K=
| 0.8 |
| 0.2×1.42 |
故答案为:80%;2.041;250℃;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
得到热化学方程式为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
点评:本题考查“原子经济性”概念的理解、化学平衡常数、化学平衡计算、反应中能量的变化等,熟练掌握基础是关键,难度中等.

练习册系列答案
相关题目
在200mL某硫酸盐溶液中,含有1.5NA个SO42-,(NA表示阿佛加德罗常数的值)同时含有NA个金属离子,则该硫酸盐的物质的量浓度为( )
| A、1mol/L |
| B、2.5mol/L |
| C、5mol/L |
| D、2mol/L |
下列各组离子在指定溶液中,可能大量共存的是( )
| A、酸性溶液中:Fe2+、Ag+、NO3-、I- |
| B、pH=1的溶液中:Na+、[Al(OH)4]-、K+、SO32- |
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、HCO3-、NH4+、SO32- |
下列说法正确的是( )
| A、乙烯和苯都能使溴水褪色,退色的原因相同 |
B、用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和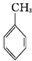 |
| C、乙炔既能使溴水退色,又能使酸性KMnO4溶液退色 |
| D、光照下2,2-二甲基丙烷与Br2反应其一溴取代物有两种 |
在下列溶液中,各组离子一定能够大量共存的是( )
| A、.使甲基橙呈黄色的溶液:Na+、NO-3、I-、K+ |
| B、.含大量Al3+的溶液:Na+、NO-3、SO2-4、HCO-3 |
| C、.由水电离出的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、.加入Al产生氢气的溶液:K+、SO2-4、Cl-、NO-3 |
下列反应中,CO2作氧化剂的是( )
| A、Ca(OH)2+CO2═CaCO3↓+H2O |
| B、CO2+C═2CO |
| C、Fe2O3+3C═4 Fe+3 CO2 |
| D、C+2H2O═2H2+CO2 |