题目内容
在气体反应中,能使反应物活化分子数和活化分子百分数同时增加的方法( )
①增加反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂.
①增加反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂.
| A、①③ | B、②⑤ | C、②④ | D、①⑤ |
考点:化学反应速率的影响因素
专题:
分析:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,能使反应物中活化分子数和活化分子百分数同时增大,可升高温度、加入催化剂等措施.
解答:
解:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,而②和⑤既能增大活化分子数,又能增大活化分子百分数,移去生成物,浓度降低,活化分子和活化分子的百分数都减小,
故选:B.
故选:B.
点评:本题考查外界条件对反应速率的影响,为高频考点,侧重双基的考查,题目难度不大,注意浓度、温度、压强、催化剂对反应速率影响的实质.

练习册系列答案
相关题目
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A、该条件下此反应的化学平衡常数约为0.91 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、B的转化率为40% |
| D、若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
通过一个阶段的复习,你认为下列说法正确的是( )
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
下列叙述正确的是( )
| A、由石墨比钢石稳定可知:C(金钢石,s)═C(石黑,s)△H>0 | ||
| B、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | ||
| C、等量H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 | ||
D、已知C(s)+O2(g)═CO2(g)△H1,C(s)+
|
根据如图,下列判断正确的是( )
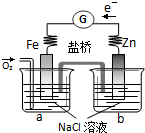

| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
下列物质不能与苯发生反应的是( )
| A、H2 |
| B、Br2 |
| C、浓HNO3 |
| D、碱性KMnO4溶液 |
下列反应中,氧化反应与还原反应在同一元素间进行的是( )
| A、Cl2+2NaOH═NaCl+NaClO+H2O | ||||
| B、Fe+CuSO4═FeSO4+Cu | ||||
C、2KClO3
| ||||
D、2H2O
|