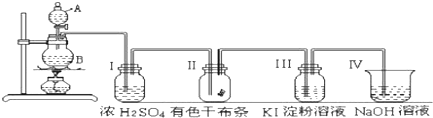
题目内容
下列各组离子在指定溶液中,可能大量共存的是( )
| A、酸性溶液中:Fe2+、Ag+、NO3-、I- |
| B、pH=1的溶液中:Na+、[Al(OH)4]-、K+、SO32- |
| C、加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、水电离的c(H+)=10-12mol?L-1的溶液中:Cl-、HCO3-、NH4+、SO32- |
考点:离子共存问题
专题:
分析:A.碘离子与银离子反应生成碘化银沉淀,硝酸根离子在酸性条件下能够氧化亚铁离子、碘离子;
B.pH=1的溶液中氢离子浓度为0.1mol/L,偏铝酸根离子、亚硫酸根离子与氢离子反应;
C.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,酸性溶液中Mg2+、NH4+、Cl-、SO42-离子之间不发生反应,也不与氢离子反应;
D.水电离的c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子、氢氧根离子反应;铵根离子与氢氧根离子、亚硫酸根离子与氢离子反应.
B.pH=1的溶液中氢离子浓度为0.1mol/L,偏铝酸根离子、亚硫酸根离子与氢离子反应;
C.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,酸性溶液中Mg2+、NH4+、Cl-、SO42-离子之间不发生反应,也不与氢离子反应;
D.水电离的c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子、氢氧根离子反应;铵根离子与氢氧根离子、亚硫酸根离子与氢离子反应.
解答:
解:A.Ag+、I-之间反应生成碘化银沉淀,NO3-在酸性溶液中能够氧化Fe2+、I-,在溶液中一定不能大量共存,故A错误;
B.该溶液为酸性溶液,溶液中存在大量氢离子,[Al(OH)4]-、SO32-与氢离子反应,在溶液中一定不能大量共存,故B错误;
C.加入Al能放出H2的溶液为酸性或碱性溶液,溶液中存在大量H+或OH-,如果在酸性溶液中,Mg2+、NH4+、Cl-、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.水电离的c(H+)=10-12mol?L-1的溶液为酸性或者碱性溶液,HCO3-、NH4+与氢氧根离子反应,HCO3-、SO32-与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
B.该溶液为酸性溶液,溶液中存在大量氢离子,[Al(OH)4]-、SO32-与氢离子反应,在溶液中一定不能大量共存,故B错误;
C.加入Al能放出H2的溶液为酸性或碱性溶液,溶液中存在大量H+或OH-,如果在酸性溶液中,Mg2+、NH4+、Cl-、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.水电离的c(H+)=10-12mol?L-1的溶液为酸性或者碱性溶液,HCO3-、NH4+与氢氧根离子反应,HCO3-、SO32-与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;本题中注意题干要求是可能共存,不是一定共存,为易错点.

练习册系列答案
相关题目
在无色、酸性溶液中,能大量共存的是( )
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
根据如图,下列判断正确的是( )
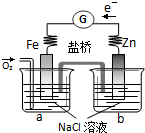

| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
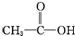 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④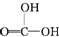 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.