题目内容
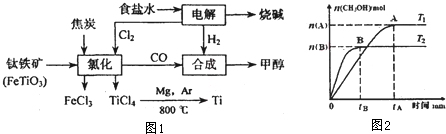
钛(Ti)被称为继铁、铝之后的第三金属.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.
请回答下列问题:
(1)电解食盐水时,总反应的离子方程式 .
(2)已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ?mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H= .
(3)在固定容积为2L的密闭容器中,加入1molCO和2molH2,发生反应:CO(g)+2H2(g)?CH3OH(g),n(CH3OH)与反应时间t的关系如图2所示.
①该反应在温度T1、T2下的平衡常数K(T1) K(T2)(填“>”、“<”或“=”).
②在温度T1下,0-tAmin内H2的平均反应速度v(H2)= mol?L-1(用图中数据表示)
③在温度T2下,若开始加入CO和H2的量是原来的2倍,则下列说法正确的是 (填字母序号)
a.H2的平衡转化率降低
b.CH3OH(g)的平衡浓度变为n(B)mol?L-1
c.达到平衡所用时间大于tBmin
d.平衡时混合气体的密度变为原来的2倍
(4)以甲醇、空气、烧碱溶液为原料,石墨为电极可构成燃料电池.该电池中负极的电极反应式为 .

请回答下列问题:
(1)电解食盐水时,总反应的离子方程式
(2)已知:
①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ?mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=
(3)在固定容积为2L的密闭容器中,加入1molCO和2molH2,发生反应:CO(g)+2H2(g)?CH3OH(g),n(CH3OH)与反应时间t的关系如图2所示.
①该反应在温度T1、T2下的平衡常数K(T1)
②在温度T1下,0-tAmin内H2的平均反应速度v(H2)=
③在温度T2下,若开始加入CO和H2的量是原来的2倍,则下列说法正确的是
a.H2的平衡转化率降低
b.CH3OH(g)的平衡浓度变为n(B)mol?L-1
c.达到平衡所用时间大于tBmin
d.平衡时混合气体的密度变为原来的2倍
(4)以甲醇、空气、烧碱溶液为原料,石墨为电极可构成燃料电池.该电池中负极的电极反应式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)电解食盐水生成氢氧化钠、氢气与氯气;
(2)依据盖斯定律解答即可;
(3)①由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小;
②根据图中甲醇的浓度变化计算出甲醇的反应速率,进而计算氢气的反应速率;
③容器为恒温恒容容器,CO(g)+2H2(g)?CH3OH(g)为气体体积减小的反应,加入的量大,平衡右移再次平衡;
(4)甲醇燃料电池中,负极上甲醇失电子发生氧化反应.
(2)依据盖斯定律解答即可;
(3)①由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小;
②根据图中甲醇的浓度变化计算出甲醇的反应速率,进而计算氢气的反应速率;
③容器为恒温恒容容器,CO(g)+2H2(g)?CH3OH(g)为气体体积减小的反应,加入的量大,平衡右移再次平衡;
(4)甲醇燃料电池中,负极上甲醇失电子发生氧化反应.
解答:
解:(1)电解食盐水生成氢氧化钠、氢气与氯气,离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1①,
Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ?mol-1②,
则①×2-②得:2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)故△H=2×(-641kJ?mol-1)-(-770kJ?mol-1)=-512kJ?mol-1;故答案为:-512kJ?mol-1;
(3)①由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,故T1、T2下的平衡常数K(T1)>K(T2);
故答案为:>;
②甲醇的反应速率V(CH3OH)=
=
,根据物质的反应速率之比等于计量数之比,故v(H2)=2V(CH3OH)=
,故答案为:
;
③容器为恒温恒容容器,CO(g)+2H2(g)?CH3OH(g)为气体体积减小的反应,加入的量大,平衡右移再次平衡,
a.平衡右移,H2的平衡转化率增大,故a错误;
b.加入CO和H2的量是原来的2倍,CH3OH(g)的平衡浓度变变大,故b错误;
c.加入CO和H2的量是原来的2倍,浓度变大,反应速率加快,达到平衡所用时间小于tBmin,故C错误;
d.质量变为原来的2倍,而容器体积不变,平衡时混合气体的密度变为原来的2倍,故d正确;
故答案为:d;
(4)该燃料电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.
| ||
| ||
(2)Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1①,
Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ?mol-1②,
则①×2-②得:2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)故△H=2×(-641kJ?mol-1)-(-770kJ?mol-1)=-512kJ?mol-1;故答案为:-512kJ?mol-1;
(3)①由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,故T1、T2下的平衡常数K(T1)>K(T2);
故答案为:>;
②甲醇的反应速率V(CH3OH)=
| △c |
| △t |
| ||
| tA |
| n(A) |
| tA |
| n(A) |
| tA |
③容器为恒温恒容容器,CO(g)+2H2(g)?CH3OH(g)为气体体积减小的反应,加入的量大,平衡右移再次平衡,
a.平衡右移,H2的平衡转化率增大,故a错误;
b.加入CO和H2的量是原来的2倍,CH3OH(g)的平衡浓度变变大,故b错误;
c.加入CO和H2的量是原来的2倍,浓度变大,反应速率加快,达到平衡所用时间小于tBmin,故C错误;
d.质量变为原来的2倍,而容器体积不变,平衡时混合气体的密度变为原来的2倍,故d正确;
故答案为:d;
(4)该燃料电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.
点评:本题考查了有关反应热的计算,原电池原理与电解原理,明确物质的量与热量的成正比的关系是解答的关键,难度中等.

练习册系列答案
相关题目
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A、该条件下此反应的化学平衡常数约为0.91 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、B的转化率为40% |
| D、若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
下列叙述正确的是( )
| A、由石墨比钢石稳定可知:C(金钢石,s)═C(石黑,s)△H>0 | ||
| B、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | ||
| C、等量H2在O2中完全燃烧,生成气态水比生成液态水放出的热量多 | ||
D、已知C(s)+O2(g)═CO2(g)△H1,C(s)+
|
下列对化学知识的归纳正确的是( )
| A、物质的俗名:Na2CO3-小苏打 NaOH-苛性钠 |
| B、物质的分类:Na2O2-碱性氧化物 Al2O3-两性氧化物 |
| C、物质的用途:过氧化钠-防毒面具中的供氧剂 氯气-制漂白粉 |
| D、物质的性质:氯化氢-在熔融状态可以导电 浊液-丁达尔现象 |