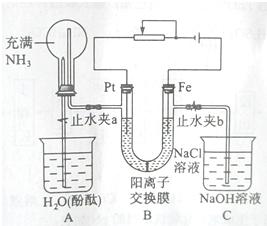
题目内容
在下列溶液中,各组离子一定能够大量共存的是( )
| A、.使甲基橙呈黄色的溶液:Na+、NO-3、I-、K+ |
| B、.含大量Al3+的溶液:Na+、NO-3、SO2-4、HCO-3 |
| C、.由水电离出的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、.加入Al产生氢气的溶液:K+、SO2-4、Cl-、NO-3 |
考点:离子共存问题
专题:
分析:A.使甲基橙呈黄色的溶液,溶液的pH>4.4,可能为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子;
B.碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
C.由水电离出的c(H+)=10-12mol?L-1的溶液为酸性或碱性溶液,K+、Ba2+、Cl-、Br-离子之间不发生反应,且不与氢离子和氢氧根离子反应;
D.加入Al产生氢气的溶液为酸性或碱性溶液,在酸性条件下,硝酸根离子具有强氧化性,加入铝无法生成氢气.
B.碳酸氢根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
C.由水电离出的c(H+)=10-12mol?L-1的溶液为酸性或碱性溶液,K+、Ba2+、Cl-、Br-离子之间不发生反应,且不与氢离子和氢氧根离子反应;
D.加入Al产生氢气的溶液为酸性或碱性溶液,在酸性条件下,硝酸根离子具有强氧化性,加入铝无法生成氢气.
解答:
解:A.使甲基橙呈黄色的溶液可能为酸性溶液,NO-3在酸性条件下能够氧化I-,在溶液中不能大量共存,故A错误;
B.Al3+与HCO3-发生双水解反应,在溶液中不能大量共存,故B错误;
C.由水电离出的c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,K+、Ba2+、Cl-、Br-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.加入Al产生氢气的溶液中存在大量氢离子或氢氧根离子,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气,在溶液中不一定能够大量共存,故D错误;
故选C.
B.Al3+与HCO3-发生双水解反应,在溶液中不能大量共存,故B错误;
C.由水电离出的c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,K+、Ba2+、Cl-、Br-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.加入Al产生氢气的溶液中存在大量氢离子或氢氧根离子,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气,在溶液中不一定能够大量共存,故D错误;
故选C.
点评:本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;特别是“可能”共存,还是“一定”共存等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
在无色、酸性溶液中,能大量共存的是( )
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
下列有关实验原理或操作正确的是( )
| A、实验室将Na2SO3溶液直接加热蒸发结晶可得到Na2SO3晶体 |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
通过一个阶段的复习,你认为下列说法正确的是( )
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol下列结论正确的是( )
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.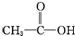 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④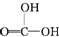 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.