题目内容
4.酒精灯的火焰分为三层,由外到内依次为外焰、内焰、焰心,若把一根洁净的铜丝,由外焰逐渐深入到内焰,能观察到什么现象?又由内焰逐渐拉出,又能观察到现象铜丝先变黑后变红,又由红变黑依次写出可能有的化学方程式2Cu+O2=2CuO;、CuO+CH3CH2OH→CH3CHO+Cu+H2O、2Cu+O2=2CuO.分析 酒精灯的外焰温度高,金属铜被氧化为氧化铜,内焰温度较低,氧化铜会被乙醇还原为金属铜,据此分析回答.
解答 解:铜丝在酒精灯的外焰被氧化而变为黑色,渐渐深入到内焰时,由于内焰温度低,一些没有燃烧的乙醇蒸气将氧化铜还原而变为红色把一根洁净的铜丝,由外焰逐渐深入到内焰,能观察到的现象是在外焰变为黑色,反应的方程式分别为:2Cu+O2=2CuO;CuO+CH3CH2OH→CH3CHO+Cu+H2O;2Cu+O2=2CuO,故答案为:铜丝先变黑后变红,又由红变黑;2Cu+O2=2CuO;、CuO+CH3CH2OH→CH3CHO+Cu+H2O、2Cu+O2=2CuO.
点评 本题考查学生金属铜和乙醇的性质,注意酒精灯的外焰温度最高,内焰温度最低,难度不大.

练习册系列答案
相关题目
7.氯碱工业是一种高能耗产业,下图表示的是电解池与燃料电池相组合的一种节能新工艺.图中电极末画出,只显示了相关物料的传输和转化关系.下列有关该工艺流程的分析正确的是( )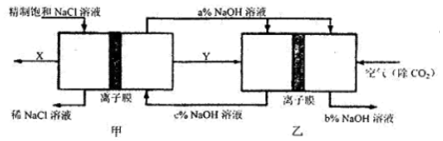

| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
9.某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.00mL、大理石用量为10.00g.
实验设计如表:
将相应的实验目的填入下列空格中:
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
实验设计如表:
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
16.氢气、铝、铁都是重要的还原剂.已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1
3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5.
2H2(g)+O2(g)=2H2O(g)△H1
3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5.
| A. | △H1<0△H3>0 | B. | △H5<0△H4<△H3 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
13.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景.
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
| A. | 2FeCO3(s)+$\frac{1}{2}$O2 (g)=Fe2O3(s)+2CO2(g)△H=+130 KJ/mol | |
| B. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=+260 KJ/mol | |
| C. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol | |
| D. | 4 FeCO3(s)+O2 (g)=2Fe2O3(s)+4CO2(g)△H=-260 KJ/mol |
14.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 2:2:1 | C. | 1:1:2 | D. | 4:3:2 |