题目内容
如图所示是元素周期表的一部分:
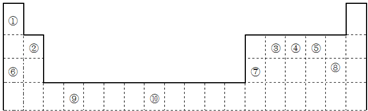
(1)元素⑨的价电子轨道表示式为 ,元素⑩的次外层电子数为 个.
(2)如果在温度接近373K时,根据M=
测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 .
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是 .(填元素代号)
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .

(1)元素⑨的价电子轨道表示式为
(2)如果在温度接近373K时,根据M=
| m |
| n |
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、Be、C、N、O、Na、Al、Cl、Ti、Fe元素,
(1)元素⑨是Ti元素,其价电子排布式为3d24s2,据此书写其价电子轨道表示式,元素⑩的次外层电子数为14个;
(2)水中存在氢键导致水分子发生缔合;
(3)元素⑦与元素②的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)①根据电离能变化知,R和U可能处于第IA族、T可能处于第IIIA族;
②T元素可能属于第IIIA族元素,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,根据其空间构型确定分子键角.
(1)元素⑨是Ti元素,其价电子排布式为3d24s2,据此书写其价电子轨道表示式,元素⑩的次外层电子数为14个;
(2)水中存在氢键导致水分子发生缔合;
(3)元素⑦与元素②的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)①根据电离能变化知,R和U可能处于第IA族、T可能处于第IIIA族;
②T元素可能属于第IIIA族元素,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,根据其空间构型确定分子键角.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、Be、C、N、O、Na、Al、Cl、Ti、Fe元素,
(1)元素⑨是Ti元素,其价电子排布式为3d24s2,其价电子轨道表示式为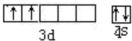 ,元素⑩的次外层电子数为14个;
,元素⑩的次外层电子数为14个;
故答案为: ;14;
;14;
(2)水中存在氢键导致水分子发生缔合导致其测量值偏大,故答案为:分子间存在氢键,H2O分子发生缔合;
(3)元素⑦与元素②的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写元素②的氢氧化物与NaOH溶液反应的离子方程式,氢氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,则氢氧化铍和氢氧化钠溶液反应生成偏铍酸钠和水,离子方程式为2OH-+Be(OH)2=BeO22-+2H2O,
故答案为:2OH-+Be(OH)2=BeO22-+2H2O;
(4)①根据电离能变化知,R和U可能处于第IA族、T可能处于第IIIA族,故答案为:R和U;
②根据电离能变化知,T元素可能属于第IIIA族元素,其最后填入的电子是p电子,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,氯化硼分子中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,则键角是120°,故答案为:p;IIIA;120°.
(1)元素⑨是Ti元素,其价电子排布式为3d24s2,其价电子轨道表示式为
 ,元素⑩的次外层电子数为14个;
,元素⑩的次外层电子数为14个;故答案为:
 ;14;
;14;(2)水中存在氢键导致水分子发生缔合导致其测量值偏大,故答案为:分子间存在氢键,H2O分子发生缔合;
(3)元素⑦与元素②的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写元素②的氢氧化物与NaOH溶液反应的离子方程式,氢氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,则氢氧化铍和氢氧化钠溶液反应生成偏铍酸钠和水,离子方程式为2OH-+Be(OH)2=BeO22-+2H2O,
故答案为:2OH-+Be(OH)2=BeO22-+2H2O;
(4)①根据电离能变化知,R和U可能处于第IA族、T可能处于第IIIA族,故答案为:R和U;
②根据电离能变化知,T元素可能属于第IIIA族元素,其最后填入的电子是p电子,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,氯化硼分子中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,则键角是120°,故答案为:p;IIIA;120°.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及键角的判断、根据电离能确定元素所处主族、氢键等知识点,根据价层电子对互斥理论确定分子空间构型、氢键对物质性质的影响等知识点分析解答,会利用知识迁移的方法解答(3)题,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列离子反应方程式正确的是( )
| A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、FeCl3溶液刻蚀铜制的印刷电路板:Cu+Fe3+=Cu2++Fe2+ |
下列关于电解质溶液的叙述正确的是( )
| A、常温下,由0.1mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH?B++OH- |
| B、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |

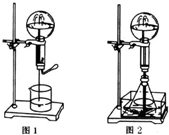 喷泉是一种常见的自然现象,其产生原因是存在压强差.
喷泉是一种常见的自然现象,其产生原因是存在压强差.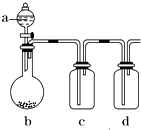 有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.