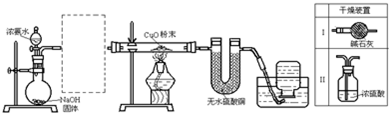
题目内容
硫及其化合物在自然界普遍存在、容易转化.
Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除.如
(1)H2S和SO2分子碰撞时,污染会降低.反应方程式为 .
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为 .
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4?2H2O).SO2被氧化的化学方程式为 .
在环保措施上,这会给我们带来“师法自然”的启示.
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染.“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法.
(4)“石灰-石膏法”吸收二氧化硫的流程为:
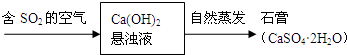
由SO2等生成石膏的总化学方程式为 .
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高.化学方程式为 .但烧碱的价格较贵(石灰0.36元/kg,烧碱2.90元/kg).
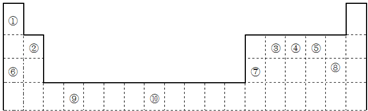
(6)若将“石灰-石膏法”和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品.请在下列流程图的①~④处填写物质的化学式:

Ⅰ.火山喷发、生物质降解时产生的有毒气体H2S、SO2等进入大气后,因一些自然转化而得以消除.如
(1)H2S和SO2分子碰撞时,污染会降低.反应方程式为
(2)H2S在常温下,会被空气逐渐氧化,反应方程式为
(3)SO2在飘尘催化下,会被空气氧化为SO3,遇水生成硫酸,硫酸遇石灰岩转化为稳定的石膏矿物(CaSO4?2H2O).SO2被氧化的化学方程式为
在环保措施上,这会给我们带来“师法自然”的启示.
Ⅱ.人为过度排放二氧化硫等,会超出自然净化吸收能力,带来严重环境污染.“石灰-石膏法”和“烧碱法”是工业上常用的工业烟气脱硫法.
(4)“石灰-石膏法”吸收二氧化硫的流程为:

由SO2等生成石膏的总化学方程式为
(5)“烧碱法”是用氢氧化钠浓溶液吸收含二氧化硫的烟气,其优点是氢氧化钠碱性强、吸收快、效率高.化学方程式为
(6)若将“石灰-石膏法”和“烧碱法”结合起来对烟气脱硫,则会产生快速高效低成本无污染的好效果,最终仍得到石膏产品.请在下列流程图的①~④处填写物质的化学式:

考点:含硫物质的性质及综合应用,二氧化硫的污染及治理
专题:元素及其化合物
分析:Ⅰ.(1)H2S和SO2分子碰撞时,二氧化硫中S元素的化合价由+4价降低为0,H2S中S元素的化合价由-2价升高为0,据此书写反应方程式;
(2)H2S中的化合价为-2价S元素,被氧气氧化成单质S,据此书写反应方程式;
(3)SO2气体在空气中经粉尘催化氧化为SO3;
Ⅱ.(4)SO2+Ca(OH)2=CaSO3+H2O,然后再将产物氧化,据此书写由SO2等生成石膏的总化学方程式;
(5)二氧化硫是酸性氧化物,和氢氧化钠反应生成亚硫酸钠和水,据此可写出化学反应式;
(6)依据流程图分析,二氧化硫与NaOH反应生成亚硫酸钠与水,亚硫酸钠在水存在的条件下被氧气氧化生成CaSO4?2H2O;①为NaOH,②为氧气,③为Ca(OH)2,④为NaOH;
(2)H2S中的化合价为-2价S元素,被氧气氧化成单质S,据此书写反应方程式;
(3)SO2气体在空气中经粉尘催化氧化为SO3;
Ⅱ.(4)SO2+Ca(OH)2=CaSO3+H2O,然后再将产物氧化,据此书写由SO2等生成石膏的总化学方程式;
(5)二氧化硫是酸性氧化物,和氢氧化钠反应生成亚硫酸钠和水,据此可写出化学反应式;
(6)依据流程图分析,二氧化硫与NaOH反应生成亚硫酸钠与水,亚硫酸钠在水存在的条件下被氧气氧化生成CaSO4?2H2O;①为NaOH,②为氧气,③为Ca(OH)2,④为NaOH;
解答:
解:Ⅰ.(1)H2S和SO2分子碰撞时,H2S中S元素的化合价由-2价升高为0,H2S为还原剂;SO2中S元素的化合价由+4价降低为0,SO2为氧化剂,两者发生:2H2S+SO2=3S+2H2O,由气体变为固体,污染会降低,
故答案为:2H2S+SO2=3S+2H2O;
(2)H2S在常温下,会被空气逐渐氧化,H2S中的化合价为-2价S元素,被氧气氧化成单质S,该反应为:2H2S+O2═2H2O+2S,
故答案为:2H2S+O2═2H2O+2S;
(3)SO2气体在空气中经粉尘催化氧化为SO3,SO3与水反应能生成硫酸,有关反应的化学方程式为:2SO2+O2
2SO3,SO3+H2O═H2SO4,
故答案为:2SO2+O2
2SO3;
Ⅱ.(4)二氧化硫与Ca(OH)2反应生成亚硫酸钙与H2O,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O,发生反应为:2SO2+2Ca(OH)2+O2+2H2O═2CaSO4?2H2O,
故答案为:2SO2+2Ca(OH)2+O2+2H2O═2CaSO4?2H2O;
(5)氢氧化钠溶液吸收二氧化硫气体生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O;
(6)依据流程图分析,①为:SO2+2NaOH═Na2SO3+H2O,②为:2Na2SO3+O2=2Na2SO4,③为:Na2SO4+Ca(OH)2═CaSO4+2NaOH,④为NaOH,
故答案为:;①为NaOH,②为氧气,③为Ca(OH)2,④为NaOH;
故答案为:2H2S+SO2=3S+2H2O;
(2)H2S在常温下,会被空气逐渐氧化,H2S中的化合价为-2价S元素,被氧气氧化成单质S,该反应为:2H2S+O2═2H2O+2S,
故答案为:2H2S+O2═2H2O+2S;
(3)SO2气体在空气中经粉尘催化氧化为SO3,SO3与水反应能生成硫酸,有关反应的化学方程式为:2SO2+O2
| 飘尘 |
故答案为:2SO2+O2
| 飘尘 |
Ⅱ.(4)二氧化硫与Ca(OH)2反应生成亚硫酸钙与H2O,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4?2H2O,发生反应为:2SO2+2Ca(OH)2+O2+2H2O═2CaSO4?2H2O,
故答案为:2SO2+2Ca(OH)2+O2+2H2O═2CaSO4?2H2O;
(5)氢氧化钠溶液吸收二氧化硫气体生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O,
故答案为:SO2+2NaOH═Na2SO3+H2O;
(6)依据流程图分析,①为:SO2+2NaOH═Na2SO3+H2O,②为:2Na2SO3+O2=2Na2SO4,③为:Na2SO4+Ca(OH)2═CaSO4+2NaOH,④为NaOH,
故答案为:;①为NaOH,②为氧气,③为Ca(OH)2,④为NaOH;
点评:本题考查了燃料脱硫的原理等,题中难度中等,注意化学方程式的书写,为该题的易错点和难点.注意流程分析和设计方法和理解是解答的关键.

练习册系列答案
相关题目
构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A、KOH |
| B、K2S |
| C、MgCl2 |
| D、SO3 |
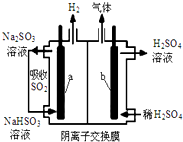 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.