题目内容
6.Ⅰ.某小组同学对一未知溶液进行了多次检测,其中三次检测结果如下表所示.| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
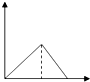
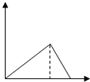
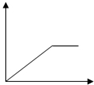
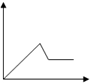
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验.可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3.相应的实验过程可用下图表示:
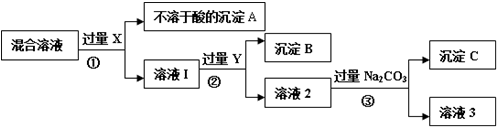
(2)写出实验流程中试剂X的化学式Ba(NO3)2.
(3)上述实验流程中加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀.
(4)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的稀HNO3除去,写出其中一个反应的化学方程式2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
分析 Ⅰ.据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,可知检测结果合理;
Ⅱ.混合溶液加入过量X(Ba(NO3)2)生成沉淀A硫酸钡,加入过量Y氢氧化钠,Mg2+能与氢氧根反应生成Mg(OH)2沉淀B,碳酸钠能与钡离子反应生成碳酸钡沉淀C,最后用稀硝酸可除去过量的碳酸根.
解答 解:Ⅰ.(1)第一次、第二次溶液中的物质之间不反应,可大量共存,则测定结果合理,
而第三次物质中发生Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3,不能大量共存,则第三次结果不合理,
故答案为:三;
Ⅱ.混合溶液加入过量X(Ba(NO3)2)生成沉淀A硫酸钡,加入过量Y氢氧化钠,Mg2+能与氢氧根反应生成Mg(OH)2沉淀B,碳酸钠能与钡离子反应生成碳酸钡沉淀C,最后用稀硝酸可除去过量的碳酸根.
(2)试剂X的化学式为Ba(NO3)2,故答案为:Ba(NO3)2;
(3)加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀,故答案为:使溶液中的Ba2+完全沉淀;
(4)加入适量的(稀)HNO3除去过量Na2CO3和氢氧化钠化学式为2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O),
故答案为:稀HNO3,2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
点评 本题综合考查了混合物的分离与提纯方法的综合应用,为高频考点,题目难度中等,是考查学生基本实验能力的一道好题,注意掌握物质分离、提纯方法及化学实验基本操作方法,明确选择除杂试剂时不能引入新的杂质,过量的试剂需要通过后面的试剂除去.

练习册系列答案
相关题目
7.下列关于化学用语叙述正确的是( )
| A. | H2O2的电子: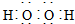 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: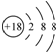 | |
| D. | FeSO4的电离方程式:FeSO4═Fe3++SO42- |
8.氧化还原反应在生活中普遍存在,下列事实中不涉及氧化还原反应的是( )
| A. | 金属锈蚀 | B. | 烟花燃放 | C. | 食物腐败 | D. | 水垢形成 |
1.食醋的主要成分是乙酸,下列物质中,能与乙酸发生反应的是( )
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
| A. | ①③④⑤⑥ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
15.下列关于钠及其化合物的说法正确的是( )
| A. | 钠的密度比水大 | |
| B. | 碳酸钠可用于治疗胃酸过多 | |
| C. | 钠着火可用湿布盖灭 | |
| D. | 过氧化钠露置于空气中会变成碳酸钠 |
16.部分短周期元素的原子半径及主要化合价如表,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.17 | 0.14 | 0.11 | 0.10 | 0.07 |
| 主要 化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与Q在同一周期 | |
| C. | M与T形成的化合物具有两性 | |
| D. | 最高价氧化物对应水化物的碱性:L<Q |