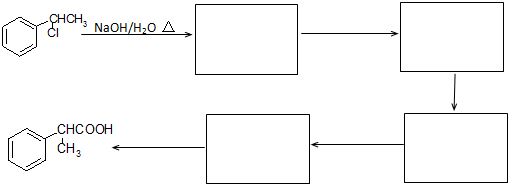
题目内容
16.部分短周期元素的原子半径及主要化合价如表,判断以下叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.17 | 0.14 | 0.11 | 0.10 | 0.07 |
| 主要 化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与Q在同一周期 | |
| C. | M与T形成的化合物具有两性 | |
| D. | 最高价氧化物对应水化物的碱性:L<Q |
分析 短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、Q之间,则M为Al元素,以此解答该题.
解答 解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、Q之间,则M为Al元素.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.M为Al,Q为Be,分别位于第三、第二周期,故B错误;
C.M与T形成的化合物是氧化铝,是两性氧化物,故C正确;
D.金属性Mg>Be,元素的金属性越强,对应的最高价氧化物对应水化物的碱性越强,故D错误.
故选C.
点评 本题考查元素的性质,为高频考点,侧重于学生的分析能力的考查,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.

练习册系列答案
相关题目
6.Ⅰ.某小组同学对一未知溶液进行了多次检测,其中三次检测结果如下表所示.
(1)三次检测结果中第三次检测结果肯定不正确.
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验.可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3.相应的实验过程可用下图表示:
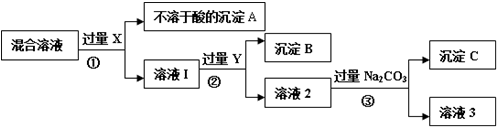
(2)写出实验流程中试剂X的化学式Ba(NO3)2.
(3)上述实验流程中加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀.
(4)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的稀HNO3除去,写出其中一个反应的化学方程式2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验.可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3.相应的实验过程可用下图表示:

(2)写出实验流程中试剂X的化学式Ba(NO3)2.
(3)上述实验流程中加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀.
(4)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的稀HNO3除去,写出其中一个反应的化学方程式2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
7.下列有关物质用途的说法错误的是( )
| A. | 乙烯作植物生长调节剂 | B. | 碳酸氢铵作化肥 | ||
| C. | 漂粉精作漂白剂 | D. | 生铁作航空材料 |
11.下列各组物质的关系的叙述中,正确的是( )
① 与
与  互为同系物 ②
互为同系物 ② 与
与 互为同分异构体③甲酸与硬脂酸互为同系物④甘氨酸(NH2CH2COOH)与硝基乙烷(CH3CH2NO2)互为同分异构体
互为同分异构体③甲酸与硬脂酸互为同系物④甘氨酸(NH2CH2COOH)与硝基乙烷(CH3CH2NO2)互为同分异构体
⑤C3H6与C4H8互为同系物 ⑥乙二酸与乙二醇互为同分异构体⑦淀粉与纤维素互为同分异构体.
①
 与
与  互为同系物 ②
互为同系物 ② 与
与 互为同分异构体③甲酸与硬脂酸互为同系物④甘氨酸(NH2CH2COOH)与硝基乙烷(CH3CH2NO2)互为同分异构体
互为同分异构体③甲酸与硬脂酸互为同系物④甘氨酸(NH2CH2COOH)与硝基乙烷(CH3CH2NO2)互为同分异构体⑤C3H6与C4H8互为同系物 ⑥乙二酸与乙二醇互为同分异构体⑦淀粉与纤维素互为同分异构体.
| A. | ①②④⑤ | B. | ③④⑦ | C. | ③④ | D. | ②③④⑤⑥⑦ |
1.下列做法正确的是( )
| A. | 用手接触药品 | |
| B. | 用嘴吹灭酒精灯 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 将带有溶液的滴管平放在实验台上 |
5.既能跟强酸反应又能跟强碱溶液反应的单质是( )
| A. | Al2O3 | B. | Al(OH)3 | C. | Al | D. | NaHCO3 |
6.己知维生素A的结构简式可写为  ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H32O | |
| B. | 维生素A不能使溴的四氯化碳溶液褪色 | |
| C. | 该有机物能发生取代反应 | |
| D. | 1mol维生素A 在催化剂作用下最多可与7molH2发生加成反应 |
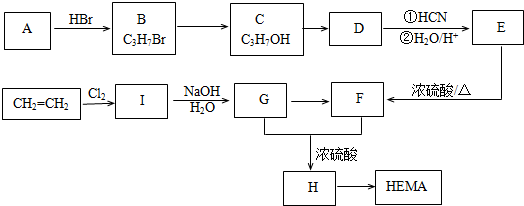
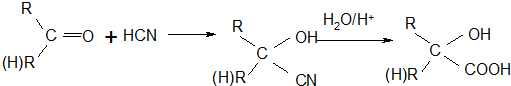
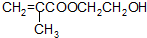 的名称为甲基丙烯酸羟乙酯,
的名称为甲基丙烯酸羟乙酯,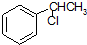 为原料制备
为原料制备 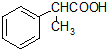 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).