题目内容
15.下列关于钠及其化合物的说法正确的是( )| A. | 钠的密度比水大 | |
| B. | 碳酸钠可用于治疗胃酸过多 | |
| C. | 钠着火可用湿布盖灭 | |
| D. | 过氧化钠露置于空气中会变成碳酸钠 |
分析 A.钠的密度小于水;
B.治疗胃酸过多,首先应选择一种能够和胃酸发生的物质,而且这种物质腐蚀性差;
C.钠和水发生剧烈反应;
D.过氧化钠和空气中水反应生成氢氧化钠和氧气,氢氧化钠吸收二氧化碳反应生成碳酸钠.
解答 解:A.钠密度小于水,在水中反应浮水面,故A错误;
B.碳酸钠碱性太强,不能用作胃药,故B错误;
C.钠与水发生反应,钠着火不可用湿布盖灭,应用沙土盖灭,故C错误;
D.过氧化钠和空气中水反应生成氢氧化钠和氧气,氢氧化钠吸收二氧化碳反应生成碳酸钠,过氧化钠露置于空气中会变成碳酸钠,故D正确;
故选D.
点评 本题考查了钠及其化合物的性质分析判断,注意知识的积累,题目难度不大.

练习册系列答案
相关题目
16.常温下,将pH值等于3的酸溶液和pH值等于11的Ba(OH)2溶液等体积混和,所得溶液的pH值( )
| A. | ≥7 | B. | ≤7 | C. | 一定等于7 | D. | 可能大于7 |
6.Ⅰ.某小组同学对一未知溶液进行了多次检测,其中三次检测结果如下表所示.
(1)三次检测结果中第三次检测结果肯定不正确.
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验.可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3.相应的实验过程可用下图表示:
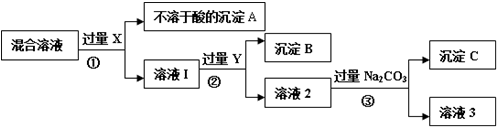
(2)写出实验流程中试剂X的化学式Ba(NO3)2.
(3)上述实验流程中加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀.
(4)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的稀HNO3除去,写出其中一个反应的化学方程式2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
Ⅱ.为了逐一除去溶液中SO42-和Mg2+并且最后所得溶液中不引入新的离子,该组同学选择适当试剂进行实验.可供选择的试剂有:稀HNO3、稀HCl、Ba(OH)2、Ba(NO3)2、NaOH、Na2CO3.相应的实验过程可用下图表示:

(2)写出实验流程中试剂X的化学式Ba(NO3)2.
(3)上述实验流程中加入过量Na2CO3的目的是使溶液中的Ba2+完全沉淀.
(4)按此实验方案得到的溶液3中肯定引入其他新的阴离子,可以向溶液3中加入适量的稀HNO3除去,写出其中一个反应的化学方程式2HNO3+Na2CO3═2NaNO3+H2O+CO2↑(或HNO3+NaOH=NaNO3+H2O).
20.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液加入少量溴水,溶液呈无色.继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,沉淀经洗涤、高温干燥后质量为4.66g.滤液加足量NaOH溶液、加热,生成气体在标准状况下体积为1120mL.
根据上述实验,以下推测正确的是( )
根据上述实验,以下推测正确的是( )
| A. | 原溶液可能存在K+、SO42- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液肯定只存在NH4+、SO32- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
7.下列有关物质用途的说法错误的是( )
| A. | 乙烯作植物生长调节剂 | B. | 碳酸氢铵作化肥 | ||
| C. | 漂粉精作漂白剂 | D. | 生铁作航空材料 |
5.既能跟强酸反应又能跟强碱溶液反应的单质是( )
| A. | Al2O3 | B. | Al(OH)3 | C. | Al | D. | NaHCO3 |
 (1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(1)写出Fe2+的最高能层的电子排布式:3s23p63d6.将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,写出该反应的化学方程式Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O. .
.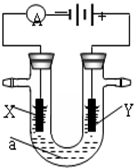 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: