题目内容
15.下列物质既具有氧化性又有还原性的是( )①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
分析 既具有还原性又具有氧化性,物质所含元素的化合价应处于中间价态,处于最高价态时只具有氧化性,处于最低价态时只具有还原性,以此解答该题.
解答 解:①SO2中S元素化合价为+4价,处于中间价态,既具有还原性又具有氧化性,故正确;
②CO2中C元素化合价为最高价态,只具有氧化性,故错误;
③Fe2+元素化合价为+2价,处于中间价态,既具有还原性又具有氧化性,故正确;
④HCl中H为+1价,具有氧化性,Cl为-1价,具有还原性,故正确;
⑤H2O2中O元素化合价为-1价,处于中间价态,既具有还原性又具有氧化性,故正确.
故选①③④⑤,
故选D.
点评 本题考查氧化还原反应,为高考常见题型,侧重于学生的分析能力的考查,明确元素化合价的变化为解答该题的关键,难度不大.

练习册系列答案
相关题目
5.有四瓶澄清透明的溶液:①MgCl2溶液;②Cu(NO3)2溶液;③K2SO4溶液;④NaOH溶液.不用其他试剂即可将它们一一鉴别出来,鉴别出来的顺序是( )
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
6. 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)
(1)上述五种酸中,酸性最强的是HNO2 (填化学式).HCO3-的电离平衡常数表达式K=$\frac{c(C{{O}_{3}}^{2-})•c({H}^{+})}{c(HC{{O}_{3}}^{-})}$.
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:
H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②c(NO2- )/c(H+) ③Ka(HNO2)
④c(H+ )/c(HNO2) ⑤c(OH -) ⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$
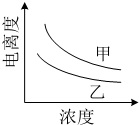
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反应醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO3-、CH3COO-、CN- b.HCO3-、CH3COOH、CN-、CO32-
c.HCN、HCO3-、CN-、CO32-d.HCN、HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:
H3BO3+OH-=B(OH)4-,则硼酸为一元酸,硼酸的电离方程式为H3BO3+H2O?B(OH)4-+H+.
(3)常温下,0.01mol•L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是④⑤(填代号).
①c(H+ ) ②c(NO2- )/c(H+) ③Ka(HNO2)
④c(H+ )/c(HNO2) ⑤c(OH -) ⑥$\frac{c({NO}_{2}^{-})}{c(H{NO}_{2})•c{(OH}^{-})}$
(4)如图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反应醋酸的是曲线乙 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数).
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是d (填代号).
a.H2CO3、HCO3-、CH3COO-、CN- b.HCO3-、CH3COOH、CN-、CO32-
c.HCN、HCO3-、CN-、CO32-d.HCN、HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作).
10.已知在碱性溶液中可发生如下反应:Fe(OH)3+Cl0-+OH-═Fe4n-+Cl-+H2O(未配平).则下列有关叙述错误的是( )
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:3 |
20.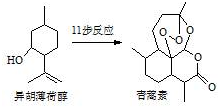 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
4.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |
