题目内容
5.有四瓶澄清透明的溶液:①MgCl2溶液;②Cu(NO3)2溶液;③K2SO4溶液;④NaOH溶液.不用其他试剂即可将它们一一鉴别出来,鉴别出来的顺序是( )| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
分析 先利用试剂的颜色可知蓝色试剂为②Cu(NO3)2溶液,剩余三种试剂中与②反应生成蓝色沉淀的为④,然后结合物质之间的反应及现象鉴别,以此来解答.
解答 解:观察首先确定色试剂为②Cu(NO3)2溶液,
剩余三种试剂中与②反应生成蓝色沉淀的为④,
剩余两种试剂为与④反应生成白色沉淀的为①,另一种为③,
则试剂鉴别的顺序为②④①③,
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.只要用一种试剂,可区别NaCl、MgSO4、FeCl2、FeCl3四种溶液,这种试剂是( )
| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
16.磷的单质和化合物有着重要的应用.磷酸铁(FePO4•2H2O,难溶于水的米白色固体)可用于药物、食品添加剂和锂离子电池的正极材料,下列实验可制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是加快Fe和稀硫酸的反应速率.
(2)为了使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是CD.
A.加热,使反应在较高温度下进行 B.用氨水调节pH=7
C.加入适当过量的H2O2溶液 D.缓慢滴加H2O2溶液并搅拌
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为Fe(OH)3(写化学式).
(4)化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可简单的理解为断开1 mol 化学键时所吸收的能量.下表是部分化学键的键能数据:
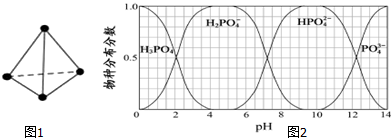
已知白磷固体(P4 结构如图1所示)的燃烧热为2378.0kJ/mol,白磷完全燃烧的固体产物结构如图1所示,则白磷燃烧的热化学方程式为P4(s)+5O2(g)=P4O10 (s)△H=:-2378.0kJ/mol;上表中X=434.
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图2所示.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5(介于此区间内的任意值或区间均可);pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-).

(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是加快Fe和稀硫酸的反应速率.
(2)为了使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是CD.
A.加热,使反应在较高温度下进行 B.用氨水调节pH=7
C.加入适当过量的H2O2溶液 D.缓慢滴加H2O2溶液并搅拌
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为Fe(OH)3(写化学式).
(4)化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可简单的理解为断开1 mol 化学键时所吸收的能量.下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图2所示.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5(介于此区间内的任意值或区间均可);pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-).
20.某研究性学习小组为探究二氧化硫的还原性,查阅到如表资料:
根据上述资料,请你参与以下探究:
(1)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-所使用的试剂是盐酸和BaCl2溶液;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是AB(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是ABC(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸.
| 资料卡 NO:2006-KI-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
(1)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-所使用的试剂是盐酸和BaCl2溶液;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是AB(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是ABC(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸.
15.下列物质既具有氧化性又有还原性的是( )
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
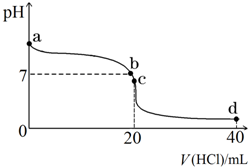 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示. .
.